
科目: 来源: 题型:
【题目】I.实验室可用KMnO4和浓盐酸反应制取氯气。
2KMnO4+16HCl(浓) ![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出电子转移的方向和数目。____________________
(2)将上述配平的化学方程式改写为离子方程式__________________________________ 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl________mol,转移的电子的数目约为____________。
II.根据反应Cu+4HNO3(浓)![]() Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原产物是______。
②氧化剂与氧化产物的物质的量之比是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJmol﹣1表示.请认真观察下图,然后回答问题.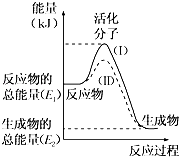
(1)图中所示反应是(填“吸热”或“放热”)反应.
(2)已知拆开1mol H﹣H键、1molI﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由1mol氢气和1mol碘反应生成HI会(填“放出”或“吸收”) kJ的热量.在化学反应过程中,是将转化为 .
(3)下列反应中,属于放热反应的是 , 属于吸热反应的是 .
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳
⑤Ba(OH)28H2O与NH4Cl反应 ⑥铁粉与稀盐酸反应.
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2的催化氧化是工业制取硫酸的关键步骤之一,该反应的化学方程式为:2SO2+O22SO3 , △H<0.
请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母).
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的是 . (填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.降低温度
(3)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L.计算该条件下反应的平衡常数K和SO2的转化率(不必写出计算过程).
①平衡常数K=;②平衡时,SO2的转化率α(SO2)=
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3 . 已知NaHSO3
溶液同时存在以下两种平衡:①HSO3﹣SO32﹣+H+ , ②HSO3﹣+H2OH2SO3+OH﹣;常温下,0.l mol/L NaHSO3溶液的pH<7,则该溶液中c(H2SO3)c(SO32﹣)(填“>”、“=”或“<”).
查看答案和解析>>
科目: 来源: 题型:
【题目】六种主族元素A、B、C、D、X、Y,其原子序数依次增大,均小于54;常温下A2B呈液态,是食物中主要营养物质之一;高纯C单质具有良好的半导体性能;D、X、Y原子核外最外层电子数均为7;过渡元素Z与B可形成多种化合物,其中红棕色粉末Z2B3常用作外墙涂料.请按要求回答下列问题:
(1)将D2水溶液滴入浅绿色的ZD2溶液中发生反应的离子方程式为 . ①学生甲认为X2和Y2都可能将Z2+氧化为Z3+ , 他推理的依据是 .
②而学生乙认为X2和Y2都不能将Z2+氧化为Z3+;学生丙认为X2能将Z2+氧化为Z3+而Y2不能.学生乙、丙推理的依据是 .
(2)A与B可形成既含极性键又含非极性键的化合物W.W的水溶液呈弱酸性,常用作无公害的消毒杀菌剂等.①W的电子式为 , W第一步电离方程式为 .
②如果配制W溶液的水中含有Z3+ , 会削弱W的消毒杀菌能力,甚至会完全失去杀菌作用.试用化学方程式分析其原因: .
(3)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族,原子核外电子层数均小于7;常温下其单质,在空气中锡、锗不反应,而铅表面会生成一层氧化铅,锗与盐酸不反应,而锡与盐酸反应.由此可得出以下结论:①锗的原子序数为;
②它们+4价氢氧化物的碱性由强到弱顺序为(填化学式) .
查看答案和解析>>
科目: 来源: 题型:
【题目】图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题: 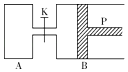
(1)达到平衡时B中X的转化率为 .
(2)平衡时A、B中混合气体的平均相对分子质量的关系是:MAMB(填“>”、“=”或“<”).
(3)打开K,一段时间后反应再次达到平衡,则B的体积为L.
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3 ![]() HCO3﹣ , 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3﹣):c(H2CO3)变化关系如下表:
HCO3﹣ , 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3﹣):c(H2CO3)变化关系如下表:
c(HCO | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO ![]() )
)
D.pH=7.40的血液中,HCO ![]() 的水解程度一定大于H2CO3的电离程度
的水解程度一定大于H2CO3的电离程度
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验基本操作(或实验注意事项)中,主要是从实验安全角度考虑的是
A. 实验剩余的药品一般不能放回原试剂瓶
B. 溶解时用玻璃棒搅拌
C. 可燃性气体点燃前必须验纯
D. 过滤时玻璃棒靠在三层滤纸处
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( ) 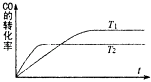
A.T1>T2
B.该反应的△H>0
C.T1时的平衡常数K1>T2时的平衡常数K2
D.T1时的平衡常数K1<T2时的平衡常数K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com