
����Ŀ����������Ԫ��A��B��C��D��X��Y����ԭ��������������С��54��������A2B��Һ̬����ʳ������ҪӪ������֮һ���ߴ�C���ʾ������õİ뵼�����ܣ�D��X��Yԭ�Ӻ���������������Ϊ7������Ԫ��Z��B���γɶ��ֻ�������к���ɫ��ĩZ2B3��������ǽͿ�ϣ��밴Ҫ��ش��������⣺
��1����D2ˮ��Һ����dz��ɫ��ZD2��Һ�з�����Ӧ�����ӷ���ʽΪ �� ��ѧ������ΪX2��Y2�����ܽ�Z2+����ΪZ3+ �� �������������� ��
�ڶ�ѧ������ΪX2��Y2�����ܽ�Z2+����ΪZ3+��ѧ������ΪX2�ܽ�Z2+����ΪZ3+��Y2���ܣ�ѧ���ҡ��������������� ��
��2��A��B���γɼȺ����Լ��ֺ��Ǽ��Լ��Ļ�����W��W��ˮ��Һ�������ԣ�����������������ɱ�����ȣ���W�ĵ���ʽΪ �� W��һ�����뷽��ʽΪ ��
���������W��Һ��ˮ�к���Z3+ �� ������W������ɱ����������������ȫʧȥɱ�����ã����û�ѧ����ʽ������ԭ�� ��
��3��Ǧ��Pb��������Sn�����ࣨGe����Ԫ��Cͬ���壬ԭ�Ӻ�����Ӳ�����С��7���������䵥�ʣ��ڿ������������Ӧ����Ǧ���������һ������Ǧ�����������Ӧ�����������ᷴӦ���ɴ˿ɵó����½��ۣ������ԭ������Ϊ��
������+4����������ļ�����ǿ����˳��Ϊ���ѧʽ�� ��
���𰸡�
��1��Cl2+2Fe2+=2Cl��+2Fe3+��Cl��Br��I���ǵڢ�A��Ԫ�أ��䵥�ʵ������Ծ���ǿ��Cl��Br��I���ǵڢ�A��Ԫ�أ����϶��·ǽ����Լ������䵥�ʵ������Լ���
��2��![]() ��H2O2?H++HO2����2H2O2
��H2O2?H++HO2����2H2O2 ![]() 2H2O+O2��
2H2O+O2��
��3��32��Pb��OH��4��Sn��OH��4��Ge��OH��4
���������⣺��������Ԫ��A��B��C��D��X��Y����ԭ��������������С��54��������A2B��Һ̬����ʳ������ҪӪ�����ʣ�A2B��H2O����AΪ��Ԫ�أ�BΪ��Ԫ�أ��ߴ�C���ʾ������õİ뵼�����ܣ�CΪSiԪ�أ�D��X��Yԭ�Ӻ���������������Ϊ7�����ڵڢ�A�壬D����Ԫ�ز����ڣ���Y��ԭ������С��54����DΪClԪ�ء�XΪBrԪ�ء�YΪIԪ�أ�����Ԫ��Z��B���γɶ��ֻ�������к���ɫ��ĩZ2B3��������ǽͿ�ϣ�ZΪFeԪ�أ���1����Cl2ˮ��Һ����dz��ɫ��FeCl2��Һ�з�����Ӧ�����ӷ���ʽΪ��Cl2+2Fe2+=2Cl��+2Fe3+ �� ���Դ��ǣ�Cl2+2Fe2+=2Cl��+2Fe3+����ѧ������ΪX2��Y2�����ܽ�Z2+����ΪZ3+ �� ������������Ӧ�ǣ�Cl��Br��I���ǵڢ�A��Ԫ�أ��䵥�ʵ������Ծ���ǿ�����Դ��ǣ�Cl��Br��I���ǵڢ�A��Ԫ�أ��䵥�ʵ������Ծ���ǿ���ڶ�ѧ������ΪX2��Y2�����ܽ�Z2+����ΪZ3+��ѧ������ΪX2�ܽ�����Z2+ΪZ3+ �� ��Y2���ܣ�ѧ���ҡ��������������ǣ�Cl��Br��I���ǵڢ�A��Ԫ�أ����϶��·ǽ����Լ������䵥�ʵ������Լ��������Դ��ǣ�Cl��Br��I���ǵڢ�A��Ԫ�أ����϶��·ǽ����Լ������䵥�ʵ������Լ�������2��A��B���γɼȺ����Լ��ֺ��Ǽ��Լ��Ļ�����W��W��ˮ��Һ�������ԣ�����������������ɱ�����ȣ�WΪH2O2 �� ��H2O2����ԭ������ԭ��֮���γ�һ�Թ��õ��Ӷԣ���ԭ��֮���γ�1�Թ��õ��Ӷԣ��ʵ���ʽΪ ![]() ����ˮ��Һ�������ԣ�Ϊ������ʣ������H+��HO2�� �� ��W��һ�����뷽��ʽΪH2O2H++HO2�� �� ���Դ��ǣ�
����ˮ��Һ�������ԣ�Ϊ������ʣ������H+��HO2�� �� ��W��һ�����뷽��ʽΪH2O2H++HO2�� �� ���Դ��ǣ� ![]() ��H2O2H++HO2���� ���������W��Һ��ˮ�к���Fe3+ �� Fe3+��H2O2�ķֽ���������ã�������Ӧ2H2O2
��H2O2H++HO2���� ���������W��Һ��ˮ�к���Fe3+ �� Fe3+��H2O2�ķֽ���������ã�������Ӧ2H2O2 ![]() 2H2O+O2����������H2O2������ɱ����������������ȫʧȥɱ�����ã�
2H2O+O2����������H2O2������ɱ����������������ȫʧȥɱ�����ã�
���Դ��ǣ�2H2O2 ![]() 2H2O+O2������3�������ٹ�Ԫ�ص���һ���ڣ�����ԭ�������γ�18�������ԭ������Ϊ14+18=32�����Դ��ǣ�32����ͬ�������϶��½�������ǿ��������Խǿ������+4����������ļ���Խǿ���ʼ�����ǿ����˳��Ϊ��Pb��OH��4��Sn��OH��4��Ge��OH��4 �� ���Դ��ǣ�Pb��OH��4��Sn��OH��4��Ge��OH��4 ��
2H2O+O2������3�������ٹ�Ԫ�ص���һ���ڣ�����ԭ�������γ�18�������ԭ������Ϊ14+18=32�����Դ��ǣ�32����ͬ�������϶��½�������ǿ��������Խǿ������+4����������ļ���Խǿ���ʼ�����ǿ����˳��Ϊ��Pb��OH��4��Sn��OH��4��Ge��OH��4 �� ���Դ��ǣ�Pb��OH��4��Sn��OH��4��Ge��OH��4 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��m mol C2H2��n mol H2���ܱ������з�Ӧ�����ÿ��淴Ӧ�ﵽƽ��ʱ������p mol C2H4 �� ����Ӧ��Ļ��������ȫȼ������CO2��H2O������Ҫ���������ʵ����ǣ� ��
A.��3m+n��mol
B.�� ![]() m+
m+ ![]() ��3p��mol
��3p��mol
C.��3m+n+2p��mol
D.�� ![]() m+
m+ ![]() ��mol
��mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʲ��ܷ�����ѧ��Ӧ����( )
A. NaOH��Һ��ϡHNO3B. AgCl��KNO3
C. CaCO3��ϡHClD. BaCl2��Һ��ϡH2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Y2O3(Y���Ƶ�Ԫ�ط���)�Ǻϳ�ij�ָ��³������ʵ�ԭ��֮һ��Y2O3��YԪ�صĻ��ϼ�Ϊ
A. ��1B. ��2C. ��3D. ��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������������ʵ��ע������У���Ҫ�Ǵ�ʵ�鰲ȫ�Ƕȿ��ǵ���
A. ʵ��ʣ���ҩƷһ�㲻�ܷŻ�ԭ�Լ�ƿ
B. �ܽ�ʱ�ò���������
C. ��ȼ�������ȼǰ�����鴿
D. ����ʱ����������������ֽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ�ǹ�ҵ��������Ҫԭ��֮һ������Ҫ�ɷ�Ϊ����������������в�����Ԫ�غ���Ԫ�أ������ʲ���H2SO4��Ӧ����ij�о���ѧϰС���ij����ʯ������������Ļ�ѧʽ����̽����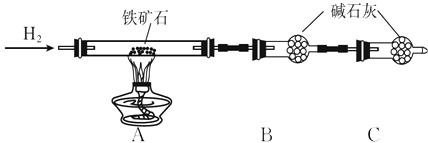
��1��������ʯ�к������IJⶨ
�ٰ���ͼ��װ���������װ�õ������ԣ�
�ڽ�5.0 g����ʯ����Ӳ�ʲ������У�װ��B��C�е�ҩƷ��ͼ��ʾ���г�������ʡ�ԣ���
�۴���˵����ܿڴ����ϵػ���ͨ��H2 �� ��Cװ�ó��ڴ�H2�鴿��ȼA���ƾ���
�ܳ�ַ�Ӧ�����ƾ��ƣ��ٳ���ͨ����������ȫ��ȴ��
A.װ��C������Ϊ ��
B.��ķ�Ӧ��װ��B����1.35 g��������ʯ�����İٷֺ���Ϊ ��
��2��������ʯ�к������IJⶨ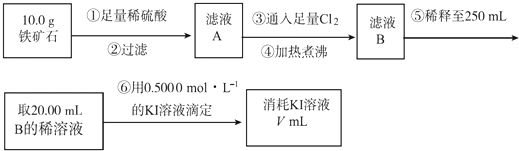
A.��������������� ��
B.��������õ��IJ����������ձ�������������ͷ�ιܡ� ��
C.�����йز���IJ�����˵����ȷ���� ��
a����Ϊ��ˮΪ��ɫ�����Եζ������в����ָʾ��
b���ζ������п����õ�����Һ��Ϊָʾ��
c���ζ���������ˮϴ�Ӻ����ֱ��װҺ
d����ƿ����Ҫ�ô���Һ��ϴ
e���ζ������У��۾�ע�ӵζ�����Һ��仯
f���ζ�������30s����Һ���ָ�ԭ������ɫ�ٶ���
D.���ζ�����������0.5000molL��1KI��Һ20.00mL��������ʯ�����İٷֺ���Ϊ ��
��3�����ɢ���������������ʯ������������Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г�ȥ���ʷ�����ȷ���ǣ� ��
A. ��ȥCO2�л��е�CO����ŨNaOH��Һϴ��
B. ��ȥBaCO3�����л��е�BaSO4���ӹ���ϡ������ˡ�ϴ��
C. ��ȥKNO3��Һ�л��е�NaCl�������ᾧ
D. ��ȥCu���л��е�CuO��������ϡ������ˡ�ϴ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ӧ����Ϊ�㷺�������Բ���֮һ������������Ŀǰ�Ʊ�������������������Ҫ��������������ͼʾ��

����˵������ȷ����
A.������ҺAʱ��Ӧ������������
B.���Ʊ���Ӧ���Ͳ�����������ԭ��Ӧ
C.ȡ��Һ������ɫ��Ӧ������Ϊ��ɫ
D.FeSO4��7H2O �� FeCl3��6H2O�����ʵ���֮�����ӦΪ2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������ʱ����ɫ��ӦΪ��ɫ�������ж���ȷ����(����)
A. ������һ�����ƵĻ�����B. ������һ������Ԫ��
C. ������һ���ǽ�����D. �������в�����Ԫ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com