
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.Ⅰ.查阅材料
①连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
②2Na2S2O4+4HCl═4NaCl+S↓+3SO2↑+2H2O
Na2S2O3+2HCl═2NaCl+S↓+SO2↑+H2O
(1)制备方法75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+Na2CO3+=Na2S2O4+CO2+
冷却至40℃~45℃,过滤,用洗涤,干燥制得Na2S2O4 .
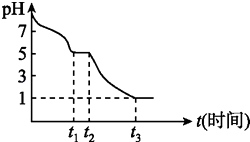
(2)Na2S2O4的性质①Na2S2O4 溶液在空气中易被氧化,课题小组测定0.050 molL﹣1 Na2S2O4 溶液在空气中pH变化如图:0~t1 段主要生成HSO3﹣ , 根据pH变化图,HSO3﹣的电离平衡水解平衡(填“<”或“>”),课题小组推测Na2S2O4 溶液在空气中易被氧化,0~t1 发生离子反应方程式为 . t3 时溶液中主要阴离子符号是 .
②隔绝空气加热Na2S2O4 固体完全分解得到固体产物Na2SO3、Na2S2O3 和气体为(填化学式).请你设计实验验证产物有Na2S2O3 存在,完成下表中内容.(供选择的试剂:稀盐酸、稀硝酸、BaCl2 溶液、KMnO4 溶液)
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2CH3OH(g)CH3OCH3(g)+H2O(g)△H=﹣25kJ/mol,某温度下的平衡常数为400.此温度下,在1L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(molL﹣1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6mol/L
③平衡吋,反应混合物的总能量减少20kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08mol/L.
A.①②④⑤
B.②⑥
C.②③④⑥
D.②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用,由此可判断二氧化氯()
A.是强氧化剂
B.是强还原剂
C.是离子化合物
D.分子中氯元素为-1价
查看答案和解析>>
科目: 来源: 题型:
【题目】自来水养金鱼时,通常先将自来水日晒一段时间后,再注入鱼缸。其目的是()
A.利用紫外线杀死水中的细菌
B.提高水温,有利金鱼生长
C.增加水中氧气的含量
D.促使水中的次氯酸分解
查看答案和解析>>
科目: 来源: 题型:
【题目】某中学化学兴趣小组学生在学习“含硫化合物的性质和应用”时,进行了如下实验探究:为了验证浓硫酸和碳在加热的情况下反应的生成物,用图Ⅰ装置进行实验。

(1)请写出碳与浓硫酸反应的化学反应方程式_________________________________;该反应中氧化剂与还原剂的物质的量之比为_____________;
(2)图Ⅰ中A处是完成实验中的必要装置,它是下图所示中的_________;(填编号)
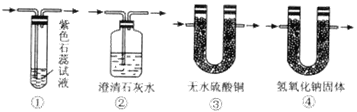
(3)图Ⅰ中C装置中应盛的试剂最好为:足够的_______________,其作用是__________________;
(4)若出现_______________________ 的实验现象,则可以确定存在二氧化碳气体。
(5)现实验小组的同学继续进行实验,他们将二氧化硫和氯气按一定的比例同时通入品红溶液中,一段时间后,发现品红溶液没有褪色。试分析实验过程中,品红不褪色的原因___________________(用离子反应方程式表示);你认为怎么样做可以让品红的颜色越来越浅?_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z三种元素,已知:①X2﹣、Y﹣均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3 , ZY3溶液遇苯酚呈紫色.
请回答:
(1)Y的最高价氧化物对应水化物的化学式是 .
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是 . 此液体具有的性质是(填序号字母).a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体.①已知一定条件下,每1 mol该气体被O2氧化放热98.0kJ.若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为 .
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)溶液在一定条件下反应,可生成一种强酸和一种氧化物.若有1.5×6.02×1023个电子转移时,该反应的化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.已知某无色溶液中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种,为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,往①的上层溶液中加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体。
回答下列问题:
(1)一定不存在的离子为:____________;
(2)需要通过焰色反应来确定是否存在Na+吗?_________(填“是”或“否”),请简要说明原因_________。
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
(1)FeCl3溶液与金属铜发生反应的化学反应方程式是__________________ ;
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,准备采用下列步骤:
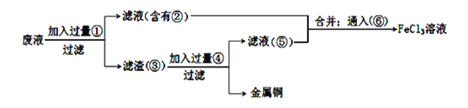
上述实验中加入或生成的有关物质的化学式为②_________ ;④____________;
若向溶液②中加入氢氧化钠溶液,其实验现象为______________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2 , 该反应的化学方程式是 .
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3 . .
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成.为检验是否有Na2SO4生成,他们设计了如下方案:将B中反应后的固体溶解于水 ![]() 白色沉淀
白色沉淀 ![]() 仍有部分白色沉淀不溶解,证明有Na2SO4生成
仍有部分白色沉淀不溶解,证明有Na2SO4生成
上述方案是否合理? . 请简要说明两点理由:
①;② .
查看答案和解析>>
科目: 来源: 题型:
【题目】屠呦呦受“青蒿一握,以水二斤渍,绞取汁”启发,改用乙醚从青蒿中提取出抗疟疾药物青蒿素。青蒿素的提取过程不包含的操作是
A. 过滤B. 灼烧C. 蒸馏D. 萃取
查看答案和解析>>
科目: 来源: 题型:
【题目】离子方程式RO3n-+F2+mOH-=RO4- +aF- +H2O,试推算未知数n=___,a=___,m=____,RO3n- 中元素R的化合价为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com