
【题目】已知:2CH3OH(g)CH3OCH3(g)+H2O(g)△H=﹣25kJ/mol,某温度下的平衡常数为400.此温度下,在1L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(molL﹣1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6mol/L
③平衡吋,反应混合物的总能量减少20kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08mol/L.
A.①②④⑤
B.②⑥
C.②③④⑥
D.②④⑥
【答案】B
【解析】解:①、该反应正反应是放热反应,升高温度平衡向逆反应进行,平衡常数降低,故平衡后升高温度,平衡常数<400,故①错误;②、由表中数据可知,CH3OH的起始浓度为0.8mol/L+2×1.24mol/L=3.28mol/L,令平衡后c(CH3OCH3)=xmol/L,根据方程式可知平衡时c(CH3OH)=(3.28﹣2x)mol/L,c(H2O)=xmol/L,所以 ![]() =400,解得x=1.6,故②正确;③、反应混合物的总能量减少等于反应放出的热量,由②中可知,平衡时后c(CH3OCH3)=1.6mol/L,所以平衡时n(CH3OCH3)=1.6mol/L×1L=1.6mol,由热化学方程式可知反应放出的热量为25kJ/mol×1.6mol=40kJ,故平衡时,反应混合物的总能量减少40kJ,故③错误;④、平衡时,再加入与起始等量的CH3OH,等效为增大压强,反应前后气体的物质的量不变,与原平衡等效,平衡后CH3OH转化率不变,故④错误;⑤、由②中可知,平衡时c(CH3OCH3)=1.6mol/L,不等于1.24mol/L,所以此时刻反应未达到平衡状态,故⑤错误;⑥、由②中可知,平衡时c(CH3OH)=(3.28﹣2x)mol/L=(3.28﹣2×1.6)mol/L=0.08mol/L,故⑥正确;故选B.
=400,解得x=1.6,故②正确;③、反应混合物的总能量减少等于反应放出的热量,由②中可知,平衡时后c(CH3OCH3)=1.6mol/L,所以平衡时n(CH3OCH3)=1.6mol/L×1L=1.6mol,由热化学方程式可知反应放出的热量为25kJ/mol×1.6mol=40kJ,故平衡时,反应混合物的总能量减少40kJ,故③错误;④、平衡时,再加入与起始等量的CH3OH,等效为增大压强,反应前后气体的物质的量不变,与原平衡等效,平衡后CH3OH转化率不变,故④错误;⑤、由②中可知,平衡时c(CH3OCH3)=1.6mol/L,不等于1.24mol/L,所以此时刻反应未达到平衡状态,故⑤错误;⑥、由②中可知,平衡时c(CH3OH)=(3.28﹣2x)mol/L=(3.28﹣2×1.6)mol/L=0.08mol/L,故⑥正确;故选B.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


科目:高中化学 来源: 题型:
【题目】在一定温度下将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
(1)用B表示的平均反应速率为 , A的转化率为 .
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度 , 混合气体平均相对分子质量(填“增大”、“减少”或“不变”).
(3)若开始时只加C和D各 ![]() mol,要使平衡时各物质的物质的量原平衡相等,则还应加入mol B物质.
mol,要使平衡时各物质的物质的量原平衡相等,则还应加入mol B物质.
(4)若向原平衡体系再投入1mol A和1mol B,平衡(填“右移、左移或不移”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5s的平均速率v(A)=0.17molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41molL﹣1 , 则反应的△H>0
C.相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20mol A,0.20mol B和1.0mol C,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)2NH3(g)△H=﹣92kJmol﹣1 , 相关数据如下定条件下,在体积为1L的密闭容器中加入1mol N2和3mol H2充分反应,放出热量Q1kJ,下列说法正确的是( )
H2(g) | N2(g) | NH3(g) | |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
A.
如图可表示合成氨过程中的能量变化
B.a的数值为391
C.Q1的数值为92
D.相同条件下,反应物若为2 mol N2和6 mol H2 , 放出热量Q2>2Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知某无色溶液中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种,为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,往①的上层溶液中加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体。
回答下列问题:
(1)一定不存在的离子为:____________;
(2)需要通过焰色反应来确定是否存在Na+吗?_________(填“是”或“否”),请简要说明原因_________。
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
(1)FeCl3溶液与金属铜发生反应的化学反应方程式是__________________ ;
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,准备采用下列步骤:
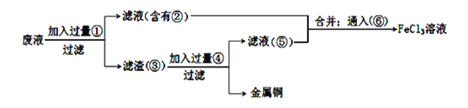
上述实验中加入或生成的有关物质的化学式为②_________ ;④____________;
若向溶液②中加入氢氧化钠溶液,其实验现象为______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于金属钠的描述不正确的是( )
A. 钠是电和热的良导体
B. 将Na投入盐酸中,Na先与水反应,生成的NaOH再与HCl反应
C. 钠的化学性质很活泼,在自然界里不能以游离态存在
D. 钠和钾的合金在室温下呈液态,可做原子反应堆的导热剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下性质的比较中,错误的是
A.热稳定性:H2S>PH3B.密度: 1-氯己烷>1-氯戊烷
C.酸性H2CO3>H2SiO3D.原子半径:Na>Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列数量的各物质所含原子个数由大到小顺序排列的是( )
①0.5 mol氨气 ②4 g氦气 ③4℃时9 mL水④0.2 mol磷酸钠
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com