
【题目】某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5s的平均速率v(A)=0.17molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41molL﹣1 , 则反应的△H>0
C.相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20mol A,0.20mol B和1.0mol C,反应达到平衡前v(正)<v(逆)
【答案】D
【解析】解:A的物质的量达到0.80mol反应达到平衡状态,则
A(g)+ | B(g) | C(g) | ||
起始量(mol) | 1.0 | 1.0 | 0 | |
变化量(mol) | 0.20 | 0.20 | 0.20 | |
平衡量(mol) | 0.80 | 0.80 | 0.20 |
K=  =0.625
=0.625
A、反应在前5s的平均速率v(A)= ![]() =0.015molL﹣1s﹣1 , 故A错误;
=0.015molL﹣1s﹣1 , 故A错误;
B、保持其他条件不变,升高温度,平衡时c(A)=0.41molL﹣1 , A物质的量为0.41mol/L×2L=0.82mol>0.80mol,说明升温平衡逆向进行,正反应是放热反应,则反应的△H<0,故B错误;
C、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,转化率下雨80%,故C错误;
D、相同温度下,起始时向容器中充入0.20mol A、0.20mol B和1.0mol C,Qc= 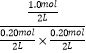 =50>K,反应逆向进行,反应达到平衡前v(正)<v(逆),故D正确;
=50>K,反应逆向进行,反应达到平衡前v(正)<v(逆),故D正确;
故选D.
依据化学平衡三段式列式计算;
A(g)+ | B(g) | C(g) | ||
起始量(mol) | 1.0 | 1.0 | 0 | |
变化量(mol) | 0.20 | 0.20 | 0.20 | |
平衡量(mol) | 0.80 | 0.80 | 0.20 |
A、依据V(A)= ![]() 计算;
计算;
B、平衡状态A的物质的量为0.8mol,升高温度,平衡时c(A)=0.41molL﹣1 , 物质的量为0.82mol,物质的量增大,说明平衡逆向进行;
C、等效为起始加入2.0mol A和2.0mol B,与原平衡相比,压强增大,平衡向正反应方向移动,平衡时的AB转化率较原平衡高,故平衡时AB的物质的量小于1.6mol,C的物质的量大于0.4mol,即相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的物质的量大于0.4mol,参加反应的C的物质的量小于1.6mol,据此判断.
D、计算平衡常数,结合起始量计算浓度商计算与平衡常数对比判断反应进行的方向.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中常见的单质,D为地壳中含量最多的金属;甲、乙、丙为化合物,其中甲为有磁性的黑色晶体,乙在常温常压下为无色液体.各物质的转化关系如下: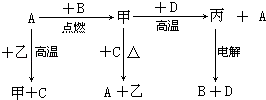
(1)组成D的元素在周期表中的位置是 .
(2)若用一种反应类型概括上述转化中所涉及到的全部反应,该反应类型是 .
(3)在上述电解反应中,阳极的极反应式是 .
(4)甲和D反应的化学方程式是 .
(5)D的某种盐常用于净水,用离子方程式表示其净水原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某工厂的工业废水中含有大量的FeSO4和较多的Fe3+和Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:

(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为________________________。
(2)加入过量物质1后,发生反应的离子方程式为___________________________。
(3)固体2是_____________________,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入_______________________。
Ⅱ.工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________(填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式__________________________。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol/L H2SO4溶液的叙述错误的是( )
A.1L该溶液中含有H2SO4的质量为9.8g
B.0.5L该溶液中氢离子的物质的量浓度为0.2mol/L
C.从1L该溶液中取出100mL,则取出溶液中H2SO4的物质的量浓度为0.01mol/L
D.取该溶液10mL,加水稀释至100mL后H2SO4的物质的量浓度为0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)═2CO2(g)△H=﹣566kJmol﹣1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJmol﹣1
由1mol CO和3mol CH4组成的混合气体在该条件下完全燃烧释放的热量为( )
A.2912 kJ
B.3236 kJ
C.2953 kJ
D.3867 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)CH3OCH3(g)+H2O(g)△H=﹣25kJ/mol,某温度下的平衡常数为400.此温度下,在1L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(molL﹣1) | 0.8 | 1.24 | 1.24 |
下列说法正确的是( )
①平衡后升高温度,平衡常数>400
②平衡时,c(CH3OCH3)=1.6mol/L
③平衡吋,反应混合物的总能量减少20kJ
④平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
⑤此时刻反应达到平衡状态
⑥平衡时CH3OH的浓度为0.08mol/L.
A.①②④⑤
B.②⑥
C.②③④⑥
D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 由一种元素组成的物质一定是单质
B. 由两种元素组成的物质一定是化合物
C. 化合物和碱性化合物属于包含关系
D. 氧化物和酸、碱、盐属于包含关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com