
科目: 来源: 题型:
【题目】(5分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3 :Si + 3HCl(g)![]() SiHCl3 + H2(g)
SiHCl3 + H2(g)
③SiHCl3与过量H2在1000-1100℃反应制得纯硅:
SiHCl3(g) + H2(g)![]() Si(s)+ 3HCl(g)
Si(s)+ 3HCl(g)
已知SiHCl3能与H2O剧烈反应,且在空气中易自燃。
用SiHCI3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)

(1)装置B中的试剂是
(2)反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 。
(3)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
(4)为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是 。(填写字母代号)
a.碘水 b.氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,说明氨有还原性和碱性的是( )
A.2NH3+3CuO ![]() 3Cu+N2↑+3H2O
3Cu+N2↑+3H2O
B.8NH3+3Cl2═6NH4Cl+N2
C.4NH3+6NO ![]() 5N2+6H2O
5N2+6H2O
D.NH3+HCl═NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、D、E 均为中学化学常见物质,它们之间的转化关系如图所示(部分产物略去,①②③④的反应条件相同).则A、E 可能的组合为( ) 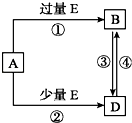
①CO2、NaOH 溶液 ②NaCl溶液、Ca(OH)2 溶液③Fe、稀HNO3 ④Na、O2 ⑤CuO,C ⑥AlCl3 溶液、NH3H2O.
A.②③④⑤
B.①③④⑤⑥
C.①②③⑤⑥
D.①③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化氢H2O2,(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是__(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是__(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO4﹣+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为:_______标准状况),被氧化的HCl的物质的量为__。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为_________。
(6)下列物质中:①NaNO3固体、②熔融KCl、③液氨、④石墨、⑤氯化氢、⑥盐酸、⑦蔗糖。其中:
属于电解质的是:__(填序号,下同);
既不是电解质也不是非电解质的是:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol氢为2 g B. H2O的摩尔质量为18 g
C. 44 g CO2的体积为22.4 L D. 9.8 g H2SO4含0.1NA个H2SO4分子
查看答案和解析>>
科目: 来源: 题型:
【题目】[物质结构与性质]
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)向一定物质的量浓度的Cu(NO3)2 和Mn(NO3)2 溶液中加入Na2CO3 溶液,所得沉淀经高温灼烧,可制得CuMn2O4 .
①Mn2+基态的电子排布式可表示为 .
②NO3﹣的空间构型是(用文字描述).
(2)在铜锰氧化物的催化下,CO 被氧化为CO2 , HCHO 被氧化为CO2 和H2O.
①根据等电子体原理,CO 分子的结构式为 .
②H2O 分子中O 原子轨道的杂化类型为 .
③1mol CO2 中含有的σ键数目为 .
(3)向CuSO4 溶液中加入过量NaOH 溶液可生成[Cu (OH)4]2﹣ . 不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列分子的立体构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH3═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4 ⑦HCHO.
A.①②③⑦
B.①⑤⑥
C.②③④⑦
D.③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志.目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 ![]() 2SO3 , 的说法不正确的是( )
2SO3 , 的说法不正确的是( )
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入2molSO2和1molO2 , 则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某儿童微量元素体检报告单的部分数据:
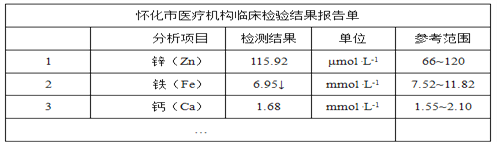
根据上表的数据,回答下列问题:
(1)该儿童__元素含量偏低。
(2)报告单中“μmol·L-1”是__(填“质量” “体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C表现出__________(填“氧化性”或“还原性”)。
(4)硫酸亚铁晶体(FeSO47H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
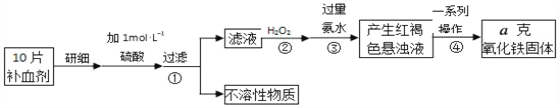
请回答下列问题:
a.②中H2O2的作用是__。
b.④中一系列处理的操作步骤为过滤、______、灼烧、冷却、称量。
c. 下列操作会导致所测定的铁元素含量偏高的是__。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
d. 写出步骤③中发生的离子方程式_____________________________________
e、简述滤液中存在Fe3+的检验方法是:_______________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(6分)“毒鼠强”是一种灭鼠药,具有极强的毒性,国家已禁止使用。它是一种含有C、H、O、N、S的有机物,其摩尔质量为240 g/mol-1 ;其中所含碳元素的质量分数为20%,所含氢元素的质量分数为3.0%氧元素的质量分数为28%,其余为N、S。(写计算过程)
(1)误食0.1 g“毒鼠强”就可以使人死亡,0.1g“毒鼠强”的物质的量为多少?
(2)试求“毒鼠强”中C、H、O三种元素的原子个数比。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com