
科目: 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( ) 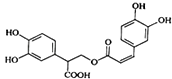
A.迷迭香酸属于芳香烃
B.1mol迷迭香酸最多能和8mol 氢气发生加成反应
C.迷迭香酸不可以发生加聚和缩聚反应
D.1mol迷迭香酸最多能和含6 mol NaOH的水溶液完全反应
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素A、B、C、D,原子序数依次增大,A原子的最外电子层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和。
(1)A元素最高价氧化物的电子式为_________,D元素的某种核素中质子数和中子数相等,该核素组成符号为_______。
(2)化合物E中存在的化学键类型为_________。
(3)A、B、C的原子半径从大到小的顺序__________________。(用对应原子符号表示);B、C、D 的简单离子的半径从大到小的顺序__________________。(用对应的离子符号表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.Si投入NaOH溶液中Si+2OH﹣═SiO ![]() +H2
+H2
B.把Al中投入到少量氢氧化钠溶液Al3++3OH﹣═Al(OH)3↓
C.向明矾水溶液中滴加氢氧化钡溶液,恰好使“SO42﹣”完全沉淀:Al3++2SO ![]() +2Ba2++2OH﹣═2BaSO4↓+Al(OH)3
+2Ba2++2OH﹣═2BaSO4↓+Al(OH)3
D.Na[Al(OH)4]溶液中加入过量的CO2:[Al(OH)4]﹣+CO2═HCO ![]() +Al(OH)3↓
+Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学方程式不正确的是( )
A.乙醇与浓氢溴酸反应?? CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
B.溴乙烷与氢氧化钠溶液共热?? CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
C.苯酚钠中通入少量的二氧化碳?? 2 ![]() +CO2+H2O→2
+CO2+H2O→2 ![]() +Na2CO3
+Na2CO3
D.乙醛催化氧化?? 2CH3CHO+O2 ![]() 2CH3COOH
2CH3COOH
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的合成原理为:N2(g)+3H2(g)2NH3(g);△H=﹣92.4KJmol﹣1 . 现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图. 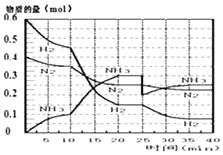
回答下列问题:
(1)10min内以NH3表示的平均反应速率;
(2)在10~20min内:NH3浓度变化的原因可能是;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡的时间范围为: , 第1次平衡:平衡常数K1=(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)2NH3(g)+ ![]() O2(g);△H=a kJmol﹣1
O2(g);△H=a kJmol﹣1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a0;△S0,(填“>”、“<”或“=”).
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。
(1)X的元素名称为________,Y的元素符号为________,Z在周期表中的位置为________;
(2)写出化合物WZX的电子式_________;
(3)实验室制取Y的简单氢化物的化学方程式为________;
(4)W2Z2可作供氧剂,当有0.1molO2生成时转移的电子数目为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如下:
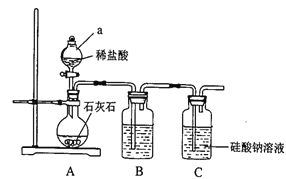
(1)连接好装置后,实验前必须进行的一步操作是_________。仪器a的名称为______。
(2)B装置中盛放的试剂是_________,C中发生反应的化学方程式为_________。
(3)该兴趣小组设计此实验通过_________(填实验现象),可判断碳的非金属性强于硅的非金属性。
(4)该小组的一位同学认为,利用此实验装置及药品,也可以证明非金属性Cl>C>Si,你是否同意该同学的观点?_________(填“同意”或“不同意”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
A.分子式为C5H10的烯烃
B.分子式为C4H8O2的酯
C.甲苯( ![]() )的一氯代物
)的一氯代物
D.立体烷( ![]() )的二氯代物
)的二氯代物
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 . 已知K2MnO4溶液显绿色.请回答下列问题:
3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 . 已知K2MnO4溶液显绿色.请回答下列问题:
(1)MnO2熔融氧化应放在中加热(填仪器编号).①烧杯②瓷坩埚③蒸发皿④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒.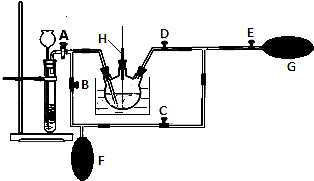
①为了能充分利用CO2 , 装置中使用了两个气囊.当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中.待气囊F收集到较多气体时,关闭旋塞 , 打开旋塞 , 轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中.然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应.
②检验K2MnO4歧化完全的实验操作是 .
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至 , 自然冷却结晶,抽滤,得到针状的高锰酸钾晶体.本实验应采用低温烘干的方法来干燥产品,原因是 .
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:2MnO4﹣+5C2O42﹣+16H+=2Mn2++10CO2↑+8H2O现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00mL待测液,用0.1000molL﹣1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为(保留4位有效数字,已知M(KMnO4)=158gmol﹣1).若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将(填“偏大”、“偏小”、“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com