
科目: 来源: 题型:
【题目】MnO2和锌是制造干电池的主要原料.电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2 , 含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如图(中间产物的固体部分已经略去):
已知各种金属离子完全沉淀的pH如表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:、 .
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2 , 其作用是 , 另外一种固体物质可为 .
(4)步骤④中电解过程中MnO2在极析出,该电极上发生的反应方程式为产品D的化学式为 , 该物质对整个生产的意义是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烷燃料电池的原理如图所示,下列说法正确的是( )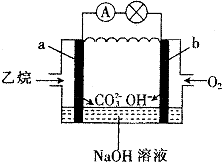
A.a为负极,电极反应式为CH3CH3﹣14e﹣+18OH﹣═2CO![]() +12H2O
+12H2O
B.电子从a极经导线移向b极,再经溶液移向a极
C.电池工作一段时间后电解质溶液的pH增大
D.用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示与对应叙述不相符的是( )
A.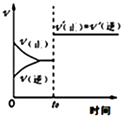 反应CO+NO2CO2+NO达平衡后,增大压强时反应速率随时间的变化
反应CO+NO2CO2+NO达平衡后,增大压强时反应速率随时间的变化
B.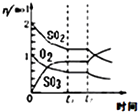 反应2SO2+O22SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化
反应2SO2+O22SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化
C.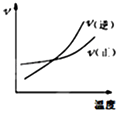 反应N2+3H 22NH3△H<0在恒容的容器中,反应速率与温度的关系
反应N2+3H 22NH3△H<0在恒容的容器中,反应速率与温度的关系
D. 反应CO2(g)+H2(g)CO(g)+H2O(g)△H>0,温度分别为T 1、T 2时水蒸气含量随时间的变化
反应CO2(g)+H2(g)CO(g)+H2O(g)△H>0,温度分别为T 1、T 2时水蒸气含量随时间的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列两组物质:①CO2、P2O5、CaO、SO2,②O2、Mg、Zn、Al。每组中有一种物质在某些化学性质或分类上与其他几种物质不同,这两种物质是①_______________,②_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是、

A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2 g该物质含有6.02×1022个原子
查看答案和解析>>
科目: 来源: 题型:
【题目】卤代烃是一类重要的有机合成中间体,是许多有机合成的原料.根据卤代烃的相关性质,回答下列问题
(1)2﹣氯﹣2﹣丁烯的键线式为 .
(2)某同学用如图1装置(铁架台、酒精灯等略)验证卤代烃的取代反应和消去反应的产物. 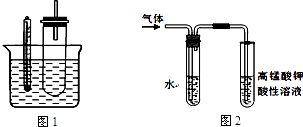 实验操作Ⅰ:在试管中加入5mL 1mol/L NaOH溶液和0.5mL溴乙烷振荡.
实验操作Ⅰ:在试管中加入5mL 1mol/L NaOH溶液和0.5mL溴乙烷振荡.
实验操作Ⅱ:将试管如图1固定后,水浴加热.
①据图1:用水浴加热而不直接用酒精灯加热的原因是 .
②图2是为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,实验中需要检验的产物是 , 水的作用是 , 实验现象是
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,装置B的试管中的现象不正确的是( )
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
|
A | 稀硫酸 | 亚硫酸氢钠 | 品红试剂 | 品红褪色 | |
B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论错误的两项是( )
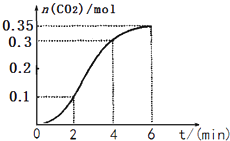
①反应开始2 min内平均反应速率最大
②反应4~6 min内平均反应速率最小
③反应开始4 min内温度对反应速率的影响比浓度大
④反应在第2 min到第4 min间生成CO2的平均反应速率最大
A. ①② B. ②③ C. ③④ D. ①③
查看答案和解析>>
科目: 来源: 题型:
【题目】在25’C时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
平衡浓度/mol/L | 0. 05 | 0. 05 | 0.1 |
下列说法错误的是
A. 反应达衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com