
����Ŀ��MnO2��п������ɵ�ص���Ҫԭ�ϣ���ⷨ����MnO2��ͳ�Ĺ�����Ҫ����Ϊ�����̿��ú��ԭ���գ���������������ϣ�����Һ����Ҫ��Mn2+�����������ٽ��е�⣬MnO2�ڵ��ص�����������90������ڷ���������MnO2��п���¹��գ���Ҫ�Dz������̿���Ҫ�ɷ�ΪMnO2 �� ������Al2O3��SiO2���ʣ�����п����Ҫ�ɷ�ΪZnS��������FeS��CuS��CdS���ʣ�Ϊ��Ҫԭ�ϣ��������Ӻõ���Zn2+��Mn2+���ӵ���Һ����ͨ�����ͬʱ���MnO2��п�������̿�ͼ��ͼ���м����Ĺ��岿���Ѿ���ȥ����
��֪���ֽ���������ȫ������pH�����
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
�ش��������⣺
��1��������У����̿���п�����������Һ����ʱ������ķ�ӦΪ������ԭ��Ӧ�����磺MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S��+2H2O����д��MnO2��������Һ�зֱ��CuS��FeS������Ӧ�Ļ�ѧ����ʽ���� ��
��2������ڼ������п��Ϊ�˻��ս��������ս�������Ҫ�ɷ�Ϊ���û�ѧ���ű�ʾ��
��3�����������C�ɶ���������ɣ����к������ֹ��壬����һ��ΪMnO2 �� �������� �� ����һ�ֹ������ʿ�Ϊ ��
��4��������е�������MnO2�����������õ缫�Ϸ����ķ�Ӧ����ʽΪ��ƷD�Ļ�ѧʽΪ �� �����ʶ����������������� ��
���𰸡�
��1��MnO2+CuS+2H2SO4=MnSO4+CuSO4+S��+2H2O��MnO2+2FeS+6H2SO4=Fe2��SO4��3+3MnSO4+2S��+6H2O
��2��Cu��Cd
��3����Fe2+����ΪFe3+��Zn��OH��2
��4������Mn2+��2e��+2H2O=MnO2+4H+��H2SO4���ܽ����̿���п����ѭ������
���������⣺��1��MnO2��������Һ�зֱ��CuS��FeS����������ԭ��Ӧ��MnԪ�صĻ��ϼ۽��ͣ�SԪ�صĻ��ϼ����ߣ���FeԪ�ػ��ϼ����ߣ��ɵ��ӡ�ԭ���غ��֪����Ӧ�ֱ�ΪMnO2+CuS+2H2SO4=MnSO4+CuSO4+S��+2H2O��MnO2+2FeS+6H2SO4=Fe2��SO4��3+3MnSO4+2S��+6H2O�����Դ��ǣ�MnO2+CuS+2H2SO4=MnSO4+CuSO4+S��+2H2O��MnO2+2FeS+6H2SO4=Fe2��SO4��3+3MnSO4+2S��+6H2O����2������ڼ������п�������·�Ӧ��Zn+CuSO4�TZnSO4+Cu��Zn+CdSO4�TZnSO4+Cd��Zn+2Fe3+�TZn2++2Fe2+ �� ���˵���ҺB�����еijɷ���MnSO4��Al2��SO4��3��ZnSO4��FeSO4 �� ����������Cu��Cd�����Ի��գ����Դ��ǣ�Cu��Cd����3����ת����֪�������ӡ�������ת��Ϊ����������һ��ΪMnO2 �� �������ǽ�Fe2+����ΪFe3+������һ�ֹ������ʿ�ΪZn��OH��2��Mn��OH��2��ZnCO3��MnCO3�ȣ��ٽ�������ˮ��ת��Ϊ���������Դ��ǣ���Fe2+����ΪFe3+��Zn��OH��2����4����MnԪ��ʧȥ���ӣ���֪������е�������MnO2�������������õ缫�Ϸ����ķ�Ӧ����ʽΪMn2+��2e��+2H2O=MnO2+4H+ �� ��������Ӳ��䣬�����������ӣ���֪��ƷD�Ļ�ѧʽΪH2SO4 �� �����ʶ����������������������ܽ����̿����п��ѭ��ʹ�ã����Դ��ǣ�����Mn2+��2e��+2H2O=MnO2+4H+��H2SO4�������ܽ����̿����п��ѭ��ʹ�ã�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ�����ú���������CO��H2���ϳɶ����ѣ�CH3OCH3��ͬʱ���ɶ�����̼����������Ӧ���£�
��2H2��g��+CO��g��CH3OH ��g����H=��90.8kJmol��1
��2CH3OH��g��CH3OCH3��g��+H2O��g����H=��23.5kJmol��1
��CO��g��+H2O��g��CO2��g��+H2��g����H=��41.3kJmol��1
��1���ܺϳɷ�Ӧ���Ȼ�ѧ����ʽΪ ��
��2��һ�������µ��ܱ������У������ܷ�Ӧ�ﵽƽ��ʱ��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��������ĸ���ţ���
A.���¸�ѹ
B.�������
C.����CO2��Ũ��
D.����CO��Ũ��
E.�����������
��3����֪��Ӧ��2CH3OH��g��CH3OCH3��g��+H2O��g����ij�¶��µ�ƽ�ⳣ��K=400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�������
���� | CH3OH | CH3OCH3 | H2O |
c/molL��1 | 0.44 | 0.60 | 0.60 |
��ʱ��v������v���棩 ���������������=�������ﵽƽ���CH3OCH3�����ʵ���Ũ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ�ҵ���������ȵĶ����ⶨ���õĻ�ѧ�������ǣ�������
A.������
B.ɫ��
C.��ɫ��
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�������Ŀ��
��1��������һ����Ҫ�ĺ����ᣮʵ������Ũ�������Ҷ��ᣨH2C2O4�����干�ȣ��ɻ��CO ��CO2�Ļ�����壬�ٽ��������һ��ͨ������һ���Լ������ƣ����ɵô��������CO���ڴ˷�Ӧ�У��������������ʣ�
��2����ˮ���ܶ�����ˮ���п��ٵ�ɱ��������ҩ��ͨ�����������㣮�������Ⱦ� Cl2Na��NCO��3����ˮ��Ӧ�����ɴ�������ɱ���������ã������Ӻ��ڲ���������ƣ�Na2SO3���ܳ����ɽ�ˮ�е����ȣ�������ȣ���ȥ�������Ⱦ�����Ԫ�صĻ��ϼ�Ϊ ��
���������ƽ�ˮ�ж���������ȥ�����ӷ�Ӧ����ʽΪ ��
������������Һ�ڿ������ױ��ʣ���д����������������Һ�Ƿ���ʵķ��� ��
��3��ij����M��һ����������������Ϊȷ���仯ѧʽ��ijС����Ʋ����������ʵ�飺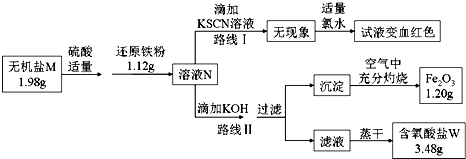
��֪��
������M���ɼ����Ӻ�һ�ֺ��������ɣ�������е�ԭ�Ӹ�����Ϊ2��1��4��
����ͼ�У���1.98g����������ˮ���μ�����ϡ������ټ���1.12g��ԭ���ۣ�ǡ����ȫ��Ӧ�û����ҺN��
�۸�С��ͬѧ����ҺN��Ϊ���ȷݣ��ֱ�·�ߢ�·�ߢ����ʵ�飮
����·�ߢ��У���������ҺN�еμ�����KOH��Ԫ��X�պó�����ȫ�����˺�����
�����г�����յô�����Fe2O3��ĩ1.20g���ٽ���Һ��һ�����������ɣ�ֻ�õ�3.48g�����IJ����ᾧˮ������W��
�밴Ҫ��ش��������⣺
����·�ߢ�������֪����ҺN�к��е��������� ��
����ʵ������ͼ���Ƶã���������W�Ļ�ѧʽ������·�ߢ��֪��1.98g����M��������Ԫ�ص�����Ϊ ��
������M��1.12g��ԭ����ǡ����ȫ��Ӧ������ҺN�Ļ�ѧ��Ӧ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��������Ƴ�������Ϊ��Ч����ƽ�����N(NO2)3(��ͼ��ʾ)����֪�÷�����N��N��N���Ƕ���108.1���������й�N(NO2)3��˵����ȷ���ǡ�

A. ������N��O���γɵĹ��ۼ��ǷǼ��Լ�
B. �������ĸ���ԭ�ӹ�ƽ��
C. �����ʼ������������л�ԭ��
D. 15.2 g�����ʺ���6.02��1022��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʱ���õ�ʯ�������ǣ� ��
A. Բ����ƿB. ������ƿC. �ձ�D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ڷǵ���ʵ��ǣ� ��
A. Һ�� B. Һ�� C. CaCO3 D. NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��E������NH4+��H+��Na+��OH����CH3COO����Cl��������������ɣ����ӿ��ظ�����NaCl��HCl���������½������ʵ���Һ��1mLϡ�͵�1000mL��pH�ı仯���ͼ��ʾ����ش�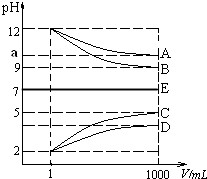
��1����֪������CH3COOH��NH3H2O �ĵ��볣����ȶ�����2��10��5 molL��1 �� E����Ϊ���ѧʽ����
��2�����ݼ�ͼ��ʾ��pH�ı仯��ϵ��д�����ʵĻ�ѧʽ��C ��
��3��25��ʱ����amol B����ˮ����������εμ�D��Һ������ǡ����ȫ��Ӧ����Һ���ԣ��ڵμ�D��Һ�Ĺ����е�ˮ�ĵ���ƽ�⽫������������������ƶ����������Һ���ֵμ�b�� D��Һ����Һ�����ԣ����μ�D��Һ��Ũ��ΪmolL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������X��Z��W����Ԫ�ؿ����XH3��H2Z��HW���ۻ����Y����Ԫ�ؿ����Y2O��Y2O2�������ӻ����
(1)д��Y2O��Y2O2�ĵ���ʽ��_______________________��________________________�����к��ߺ��еĻ�ѧ����______________������Ӽ����������Լ����Ǽ��Լ�������
(2)XH3��H2Z��HW���ֻ�����е���ߵ���____________(�ѧʽ)��
(3)X��Z��W����Ԫ�ص�����������Ӧ��ˮ�����У�������ǿ����_________(�ѧʽ)��
(4)�õ���ʽ��ʾY2O���γɹ���______________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com