
【题目】对于工业废气中余氯的定量测定常用的化学分析法是( )
A.碘量法
B.色谱法
C.比色法
D.重量法
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。请回答:
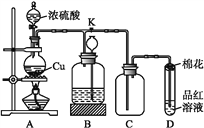
(1)装置A中发生反应的化学方程式为_______________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中长颈漏斗内液面上升,广口瓶内液面下降,则B中应放置的液体是(填字母)___。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和V L 18 mol·L-1硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是__(填字母)。
A.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
③实验结束时测得铜减少了3.2 g,则被还原的硫酸的物质的量为_____mol;转移的电子为_____mol;反应后溶液中硫酸根离子的物质的量浓度为_________mol·L-1。(反应后溶液的体积为V L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属的说法不正确的是![]()
A. 均为ⅠA族元素,最外层均有1个电子
B. 单质的还原性: ![]()
C. 碱性: ![]()
D. 由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中不正确的是( )
A. 向试管中滴加液体时,胶头滴管紧贴试管内壁
B. 过滤时,漏斗下端紧贴烧杯内壁
C. 加热试管内物质时,试管底部与酒精灯外焰接触
D. 过滤时,玻璃棒与三层滤纸的一边接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述正确的是( )
A.高聚物的相对分子质量一定为单体相对分子质量的整数倍
B.![]() 分子中只存在羧基、羟基两种官能
分子中只存在羧基、羟基两种官能
C.PETG的结构简式为: ![]() 合成PETG的单体有4种
合成PETG的单体有4种
D.![]() 分子中至少有16个原子共平面
分子中至少有16个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的![]() ,较多的
,较多的![]() 和少量
和少量![]() 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜
为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜![]() 请根据下列流程图,完成回收硫酸亚铁和铜的实验方案
请根据下列流程图,完成回收硫酸亚铁和铜的实验方案![]() 可供选择的试剂为铁粉、稀
可供选择的试剂为铁粉、稀![]() 、NaOH溶液等试剂
、NaOH溶液等试剂![]()
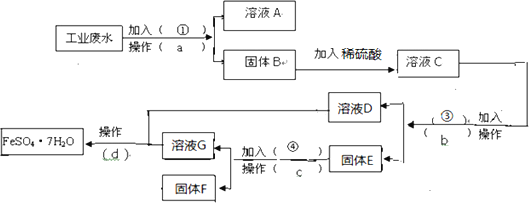
(1)操作a的名称为 ______ ,所需要的玻璃仪器为 ______ .
(2)固体E的成分为 ______ ,加入的试剂![]() 为 ______ ,发生的化学方程式为 ______ .
为 ______ ,发生的化学方程式为 ______ .
(3)加入试剂![]() 的目的是 ______ .
的目的是 ______ .
(4)从溶液D和溶液G中得到![]() 晶体的操作为 ______ 、冷却结晶、 ______ 、洗涤、干燥.
晶体的操作为 ______ 、冷却结晶、 ______ 、洗涤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于定量实验中的基本操作和仪器的描述正确的是( )
A.用托盘天平称取20.00 g NaOH固体
B.用碱式滴定管准确量取20.00 mL K2Cr2O7溶液
C.用电子(分析)天平测得铁片质量是15.524 g
D.在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时再加入蒸馏水使其液面与刻度线持平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和锌是制造干电池的主要原料.电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2 , 含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如图(中间产物的固体部分已经略去):
已知各种金属离子完全沉淀的pH如表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:、 .
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2 , 其作用是 , 另外一种固体物质可为 .
(4)步骤④中电解过程中MnO2在极析出,该电极上发生的反应方程式为产品D的化学式为 , 该物质对整个生产的意义是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)H2O2的电子式 .
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式 .
(4)完成以下氧化还原反应的离子方程式: MnO4﹣+C2O42﹣+=Mn2+CO2↑+ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com