
【题目】下列操作中不正确的是( )
A. 向试管中滴加液体时,胶头滴管紧贴试管内壁
B. 过滤时,漏斗下端紧贴烧杯内壁
C. 加热试管内物质时,试管底部与酒精灯外焰接触
D. 过滤时,玻璃棒与三层滤纸的一边接触
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】下列结论均出自《实验化学》中的实验,其中错误的是( )
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据
C.镀锌铁皮发生电化学腐蚀时,锌发生氧化反应
D.食醋的总酸含量是指食醋中醋酸的总物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
①2H2(g)+CO(g)CH3OH (g)△H=﹣90.8kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41.3kJmol﹣1
(1)总合成反应的热化学方程式为 .
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是(填字母代号).
A.高温高压
B.加入催化剂
C.减少CO2的浓度
D.增加CO的浓度
E.分离出二甲醚
(3)已知反应②2CH3OH(g)CH3OCH3(g)+H2O(g)在某温度下的平衡常数K=400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如表格:
物质 | CH3OH | CH3OCH3 | H2O |
c/molL﹣1 | 0.44 | 0.60 | 0.60 |
此时,v(正)v(逆) 填“>”、“<”或“=”);达到平衡后,CH3OCH3的物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL 0.1molL﹣1 Na2CO3溶液中逐滴加入0.1molL﹣1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( ) 
A.在0.1 mol?L﹣1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO ![]() )+c(HCO
)+c(HCO ![]() )+c(OH﹣)
)+c(OH﹣)
B.当溶液的pH为7时,溶液的总体积为20 mL
C.在B点所示的溶液中,浓度最大的阳离子是Na+
D.在A点所示的溶液中:c(CO ![]() )=c(HCO
)=c(HCO ![]() )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的铜片与![]() 浓硫酸加热充分反应,收集到标准状况下的
浓硫酸加热充分反应,收集到标准状况下的![]() 气体VL,下列对此反应的有关说法中错误的是
气体VL,下列对此反应的有关说法中错误的是 ![]()
A. 该反应体现了浓硫酸的酸性和强氧化性
B. 反应结束后两种反应物均有剩余
C. 被还原的硫酸为![]()
D. 参加反应的Cu为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是( )
A. ①②③④B. ②③C. ①②④D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成题目:
(1)硫酸是一种重要的含氧酸.实验室用浓硫酸与乙二酸(H2C2O4)晶体共热,可获得CO 与CO2的混合气体,再将混合气进一步通过(填一种试剂的名称)即可得纯净干燥的CO.在此反应中,硫酸体现了性质.
(2)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层.外层的优氯净 Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去.①优氯净中氯元素的化合价为 .
②亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 .
③亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 .
(3)某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验: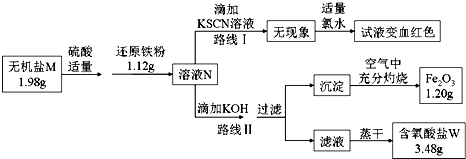
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其分子中的原子个数比为2:1:4;
②上图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在
空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
①由路线Ⅰ的现象可知,溶液N中含有的阳离子是 .
②由实验流程图可推得,含氧酸盐W的化学式是;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 .
③无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A~E都是由NH4+、H+、Na+、OH﹣、CH3COO﹣、Cl﹣中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答: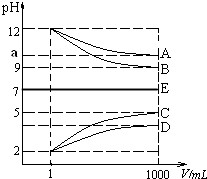
(1)已知常温下CH3COOH和NH3H2O 的电离常数相等都等于2×10﹣5 molL﹣1 , E可能为(填化学式).
(2)根据甲图显示的pH的变化关系,写出物质的化学式:C .
(3)25℃时,将amol B溶于水,向其中逐滴滴加D溶液至二者恰好完全反应,溶液显性,在滴加D溶液的过程中的水的电离平衡将(填”正向”“不”或“逆向”)移动;若向该溶液中又滴加b升 D溶液后溶液呈中性,所滴加D溶液的浓度为molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com