
【题目】物质A~E都是由NH4+、H+、Na+、OH﹣、CH3COO﹣、Cl﹣中离子两两组成(离子可重复,如NaCl、HCl).常温下将各物质的溶液从1mL稀释到1000mL,pH的变化如甲图所示.请回答: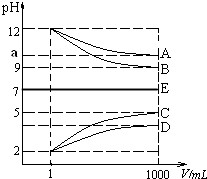
(1)已知常温下CH3COOH和NH3H2O 的电离常数相等都等于2×10﹣5 molL﹣1 , E可能为(填化学式).
(2)根据甲图显示的pH的变化关系,写出物质的化学式:C .
(3)25℃时,将amol B溶于水,向其中逐滴滴加D溶液至二者恰好完全反应,溶液显性,在滴加D溶液的过程中的水的电离平衡将(填”正向”“不”或“逆向”)移动;若向该溶液中又滴加b升 D溶液后溶液呈中性,所滴加D溶液的浓度为molL﹣1 .
【答案】
(1)NaCl,CH3COONH4
(2)HCl
(3)碱;向;![]()
【解析】解:根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸,(1)E溶液呈中性,则E为强酸强碱盐或弱酸弱碱盐,且弱酸和弱碱的电离程度相等,因为醋酸和一水合氨的电离程度相等,所以E可能是NaCl或CH3COONH4 , 所以答案是:NaCl或CH3COONH4;(2)通过以上分析知,C是HCl,所以答案是:HCl;(3)B是氢氧化钠、D是醋酸,二者恰好反应生成CH3COONa,醋酸钠在溶液中水解,溶液显碱性;NaOH溶液中滴加醋酸,溶液中氢氧根离子浓度减小,对水的电离的抑制程度减小,水的电离平衡正向移动;将a mol NaOH溶于水,向该溶液滴加b L CH3COOH后溶液呈中性,则溶液中氢氧根离子浓度为10﹣7mol/L,根据电荷守恒可知c(Na+)=c(CH3COO﹣),设混合后溶液体积为1L,c(Na+)=c(CH3COO﹣)=amol/L,已知醋酸的电离平衡常数取Kb=2×10﹣5 molL﹣1 , 则Kb= ![]() =
= ![]() =2×10﹣5 , 所以c(CH3COOH)=
=2×10﹣5 , 所以c(CH3COOH)= ![]() mol/L;所以答案是:碱;正向;
mol/L;所以答案是:碱;正向; ![]() .
.
【考点精析】通过灵活运用弱电解质在水溶液中的电离平衡,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理即可以解答此题.


科目:高中化学 来源: 题型:
【题目】下列操作中不正确的是( )
A. 向试管中滴加液体时,胶头滴管紧贴试管内壁
B. 过滤时,漏斗下端紧贴烧杯内壁
C. 加热试管内物质时,试管底部与酒精灯外焰接触
D. 过滤时,玻璃棒与三层滤纸的一边接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和锌是制造干电池的主要原料.电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2 , 含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如图(中间产物的固体部分已经略去):
已知各种金属离子完全沉淀的pH如表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:、 .
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2 , 其作用是 , 另外一种固体物质可为 .
(4)步骤④中电解过程中MnO2在极析出,该电极上发生的反应方程式为产品D的化学式为 , 该物质对整个生产的意义是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确量取25.00 mL高锰酸钾溶液,可选用的仪器是( )
A.50 mL量筒
B.10 mL量筒
C.50 mL酸式滴定管
D.50 mL碱式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验现象能确定试样中一定有Cl─的是
A.滴加AgNO3溶液有白色沉淀 B.滴加硝酸酸化的Ba(NO3)2有白色沉淀
C.滴加硝酸酸化的AgNO3溶液有白色沉淀 D.滴加硫酸酸化的AgNO3溶液有白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的化合物是优良的催化剂,可用于干电池原料生产等.
(1)锌锰干电池的反应为2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2 , MnO(OH)中锰元素的化合价为 .
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为(填化学式).[已知Ksp(MnS)=1.4×10﹣15 , Ksp(ZnS)=2.9×10﹣25 , Ksp(FeS)=6.0×10﹣18]
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g)△H1 , 其反应机理如图:
①已知反应Ⅱ为MnO2(s)+H2O2(1)+2H+ ( aq)=Mn2+ (aq)+O2(g)+2H2O(1)△H2 . 写出反应 I的热化学方程式(焓变用△H1和△H2表示): .
②某温度时,向10mL0.4mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2=2H2O+O2 , 测得不同时刻生成O2的体积(已折算为标准状况下的体积)如表:
t/min | 0 | 2 | 4 | 6 |
V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
0~2min时反应速率比2~4min时的快,其原因是 , 0~6min的平均反应速率v(H2O2)=(忽略溶液体积的变化).
(4)锰基催化剂是合成甲醇、二甲醚的催化剂.已知:
反应 | 平衡常数KP | |
773K | 873K | |
Ⅰ.CO2(g)+4H2(g)CH4(g)+2H2(g) | 19.4 | 0.803 |
Ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
①反应I的正反应是(填“放热”或“吸热”)反应.
②反应Ⅱ的平衡常数表达式为 . 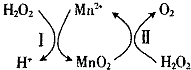
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)H2O2的电子式 .
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式 .
(4)完成以下氧化还原反应的离子方程式: MnO4﹣+C2O42﹣+=Mn2+CO2↑+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液混合后,不会发生离子反应的是( )
A. 硝酸钡溶液和硫酸钠溶液B. 醋酸钠溶液和稀硫酸
C. 碳酸钾溶液和硫酸氢钠溶液D. 硝酸钾溶液和氯化铜溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com