
科目: 来源: 题型:
【题目】根据题意填空
(1)2SO2(g)+O2(g) △ v 2 O 5 2SO3(g);△H=﹣196.6KJ/mol,是制备硫酸的重要反应.下列关于该反应的叙述正确的是 . (填字母)
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1 , c2 , 则时间间隔t1~t2内,SO3(g)生成的平均速率为u= c 2 c 1 t 2 t 1
E.使用催化剂V2O5能提高SO2的转化率
F.使用催化剂V2O5会改变该反应的△H
(2)判断该反应达到平衡状态的标志是 .(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.在体积不变的容器中,气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.在体积不变的容器中混合气体,的密度保持不变
f.SO2、O2、SO3的浓度比保持不变.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ①和④ D. ③和④
查看答案和解析>>
科目: 来源: 题型:
【题目】氯及其化合物对人类生产及生活有重要作用。
(1)氯的原子结构示意图为_______;实验室氯气的尾气处理常用NaOH溶液,请用离子方程式表示该反应:________;工业上将氯气通入冷的消石灰制取漂白粉,漂白粉的有效成分是___(填化学式)。
(2)NaClO2的漂白能力是漂白粉的4到5倍。NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
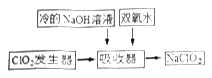
①发生器中用NaClO3与Na2SO3在酸性环境下反应制备ClO2,则氧化剂与还原剂的物质的量之比为:_____________。
②吸收器中生成NaClO2反应的离子方程式为_______,吸收器中的反应温度不能过高,可能的原因为__________。
③Cl2和ClO2均能将工业废水中得CN-氧化成无毒的物质,而自身被还原为Cl-,则处理相同量的CN-所需Cl2的质量是ClO2的多少倍。______(计算结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下在密闭容器中发生如下反应:2M(g)+N(g)2E(g)若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为( )
A.20%
B.40%
C.60%
D.80%
查看答案和解析>>
科目: 来源: 题型:
【题目】“神舟”号载人航天器中,宇航员所在的返回舱都是密封的,宇航员吸入氧气,呼出二氧化碳,如果二氧化碳浓度过大,会使宇航员困乏,呼吸频率加快,严重的会窒息,为使二氧化碳浓度降低而保持舱内氧气的适当比例,可以在返回舱内放入( )
A. 过氧化钠B. 碳酸钠C. 氢氧化钠D. 氧气瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】非金属虽然种类虽然不多,但是与人类的关系密切,回忆几种常见非金属一硅、氯、硫、氮及其化合物的重要性质,回答下列问题:
(1)在无机非金属材料中,硅一直扮演着主要的角色,有下列物品或设备:①陶瓷餐具②砖瓦③水泥路桥④门窗玻璃⑤水晶镜片⑥人工制造的分子筛⑦玛瑙手镯⑧硅太阳能电池⑨石英光导纤维⑩计算机芯片。所用材料为SiO2或要用到SiO2的是_______。
A.④⑤⑦⑧⑨ B.④⑤⑦⑨ C.④⑤⑦⑨ D.①④⑤⑦⑨⑩
(2)1774年,瑞典化学家舍勒在研究软锰矿的过程中发现了氯气。现为了进行有关氯气的性质实验,需要4瓶容积为50mL的氯气(室温下,氯气的密度约为2.9g/L),则用舍勒的方法制取3瓶氯气理论上需要MnO2固体的质量是_____g(保留到小数点后一位,浓盐酸过量,可以补充);实际称量的MnO2固体的质量必须多于理论量,其原因是_____,由于氯气有毒,拆除装置时需要对反应装置内氯气进行处理,以下最理想的吸收剂是_____
A.NaOH溶液 B.浓氨水 C.澄清石灰水 D.水
(3)硫酸和硝酸都是重要的化工原料,在工业上可以用于制化肥、农药、炸药、盐类等。
①现以洗净的废铜屑和浓硝酸为原料,制取硝酸铜,请设计一个既能节约原料又能防止污染环境的方法(用化学方程式表示)____________。
②下列现象中硫酸所表现出的性质中含有强氧化性的是________。
A.把锌粒放入稀硫酸中时,有气体放出
B.盛有浓硫酸的烧杯敞口放置一段时间后,质量增加
C.把浓硫酸倒入润湿的蔗糖中,蔗糖变黑,且有刺激性气味气体生成
D.把木炭放入热的浓硫酸中时,有气体放出
E.在常温下可以用铁、铝制容器盛装冷的浓硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃ 和101kpa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了72mL,原混合烃中乙炔的体积分数为( )
A.12.5%
B.25%
C.50%
D.75%
查看答案和解析>>
科目: 来源: 题型:
【题目】新型纳米材料氧缺位铁酸盐(MFe2Ox)(32、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述不正确的是
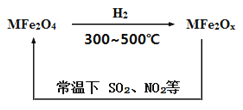
A. MFe2O4表现了氧化性
B. 若MFe2Ox与SO2发生反应的物质的量之比为3:1,则x=10/3
C. 在处理该废气过程中,每处理含1moINO2的废气转移电子数4NA个
D. MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】因为氨气与氧化铜反应产物无污染,所以工业上常用氨气还原氧化铜制取铜。巴蜀中学化学兴趣小组为了模拟该反应并同时完成铜的相对原子质量的测定,设计如下所示的装置图并完成相关实验:
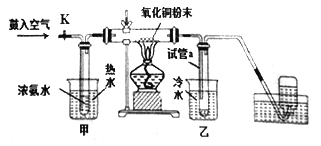
假定,测定铜的相对原子质量的实验过程中,氧化铜充分反应。以下叙述错误的是
A. 关闭K的情况下完成实验,测得试管最终收集到的液体质量和氧化铜的质量可以求出铜的相对原子质量
B. 关闭K的情况下完成实验,测得氧化铜的粉末的反应前后的质量和最终集气瓶中收集到的气体体积(标准状况下)可以求出铜的相对原子质量
C. 直型玻璃管中发生的反应为:3CuO+2NH3![]() N2↑+3Cu+3H2O
N2↑+3Cu+3H2O
D. 若打开K,鼓入空气,直型玻璃管中氧化铜粉末会交替出现黑色变红色,红色变黑色的现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com