
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
9.25℃时,将某一元酸HA和NaOH溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的pH如下表:(假设混合后溶液体积等于混合前两种溶液的体积之和,下同)
|
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解

| 滴定 次数 |
量取KMnO4溶液的体积(mL) | 标准草酸溶液的体积 | 平均值 (mL) | ||
| 滴定前刻度 | 滴定后刻度 | 实际体积(mL) | |||
| 第一次 | 5.00 | 0.00 | 19.60 | ||
| 第二次 | 5.00 | 0.20 | 19.60 | ||
| 第三次 | 5.00 | 0.06 | 18.06 | ||
查看答案和解析>>
科目: 来源: 题型:
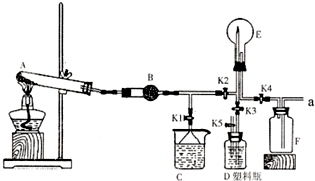 如图是实验室中某种气体的制备、性质检验及收集装置图.
如图是实验室中某种气体的制备、性质检验及收集装置图.
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
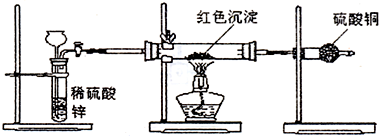
查看答案和解析>>
科目: 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
| 压强/Mpa 转化率 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目: 来源: 题型:阅读理解

| ||
| △ |
| ||
| △ |
| 8a |
| 29 |
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 实验现象 | 反应离子方程式和结论 |
| ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com