
科目: 来源: 题型:
【题目】A,B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g)△H<0.达到化学平衡后测得A的浓度为0.5molL﹣1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.9molL﹣1 . 则下列有关判断正确的是( )
zC(g)△H<0.达到化学平衡后测得A的浓度为0.5molL﹣1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.9molL﹣1 . 则下列有关判断正确的是( )
A.平衡向正反应方向移动了
B.x+y<z
C.B的转化率下降
D.C的体积分数减小
查看答案和解析>>
科目: 来源: 题型:
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
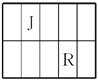
(1)M的离子结构示意图为________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为_____________________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为________________________________________________________________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
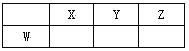
(1)X元素在元素周期表中的位置________________。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为_________。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______________。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器_____(填“能”或“不能”)用来腌制咸菜,原因是____________________________。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式_____________________________________。关于该电池的下列说法,正确的是_______

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:_________________
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯(![]() )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
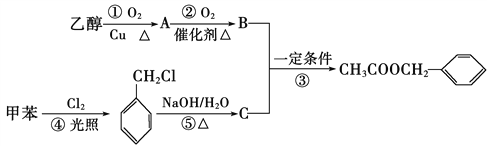
(1)B、C的结构简式分别为________、________。
(2)写出反应①、③、④的化学方程式:
①______________________________________________________________;
④______________________________________________________________。
③______________________________________________________________;
(3)反应①、③、④、⑤的反应类型分别为①______③______,④_____,⑤_____。
(4)反应______(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
(5)A中官能团的名称是___________,检验这种官能团除了可以用银氨溶液还可以用______(填名称)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
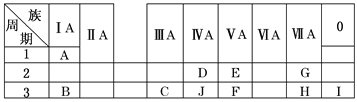
(1)表中元素,化学性质最不活泼的是________,只有负价而无正价的元素是________。
(2)C元素在元素周期表中的位置是第三周期第________族。
(3)最高价氧化物的水化物酸性最强的是________,呈两性的是________。
(4)A分别与E、G、H形成的化合物中,最稳定的是________。
(5)在B、C、E、F中,原子半径最大的是________。
(6)B、H两种元素所形成的化合物所含的化学键类型为________________。
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:__________________________。
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、恒容的容器中进行反应:2HIH2+I2(正反应为吸热反应),反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需时间为( )
A.等于10 s
B.等于12 s
C.大于12 s
D.小于12 s
查看答案和解析>>
科目: 来源: 题型:
【题目】糖尿病患者的糖代谢功能紊乱,以高血糖为主要标志。血糖是指血液中的葡萄糖,下列有关说法正确的是( )
A.葡萄糖分子可表示为C6(H2O)6,则每个葡萄糖分子含有6个水分子
B.葡萄糖与果糖互为同素异形体
C.糖尿病人尿糖较高,可用久置的氢氧化铜来检测病人尿液中的葡萄糖
D.淀粉水解的最终产物是葡萄糖
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+ ![]() O2(g)△H=+242kJmol﹣1
O2(g)△H=+242kJmol﹣1
B.2H2(g)+O2(g)=2H2O(l)△H=﹣484kJmol﹣1
C.H2(g)+ ![]() O2(g)=H2O(g)△H=+242kJmol﹣1
O2(g)=H2O(g)△H=+242kJmol﹣1
D.2H2(g)+O2(g)=2H2O(g)△H=+484kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
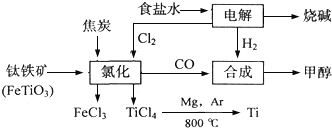
(1)写出电解食盐水反应的离子方程式________________________________。阳极上每生成标准状况下的11.2L气体,转移电子的物质的量是_______
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
(3)反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是__________.
2MgCl4+Ti在Ar气氛中进行的理由是__________.
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2_______t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是___________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g) ![]() CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5 kJ·mol-1
③ CO(g) + H2O(g) ![]() CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
CO2(g) + H2(g);ΔH= -41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g) ![]() CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g) ![]() CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。达到平衡时甲醇的转化率α(CH3OH)= _________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com