
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活、环境等各方面紧密相关,下列相关说法正确的是
A. 机动车单双号限行是从根本上解决汽车尾气污染问题的一种途径
B. 油锅着火应立即用水浇灭
C. 石灰乳刷墙后逐渐变硬的原因是石灰乳在空气中逐渐失水干燥
D. 我们已将PM2.5纳入空气质量检测报告
查看答案和解析>>
科目: 来源: 题型:
【题目】将5.4 g Al 投入到200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A. HNO3溶液 B. Ba(OH)2溶液 C. H2SO4溶液 D. HCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】现有含FeCl2杂质的氯化铜晶体(CuCl22H2O),为制取纯净的CuCl22H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯: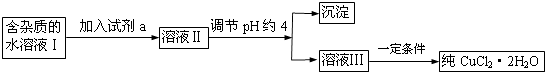
25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 4.7 |
完成沉淀pH | 3.2 | 9.7 | 6.7 |
请回答下列问题:
(1)流程中加入的试剂a最合适的是(填序号)A.酸性高锰酸钾溶液 B.NaClO溶液C.H2O2溶液 D.稀硝酸
加入试剂a的目的是 .
(2)调节pH约4应该加入的物质可以是 .
A.CuO
B.CuCl2
C.Cu(OH)2
D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl22H2O?(填“能”或“不能”).
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子能大量共存于同一溶液中的是( )
A.Fe2+ H+ NO3﹣ SO42﹣
B.Fe3+ NH4+ Cl﹣ I﹣
C.Cu2+ Mg2+ NO3﹣ Cl﹣
D.Al3+ Na+ SO42﹣ OH﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1,若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ·mol-1 NO(g)+1/2O2(g)=NO2(g) △H=-58.2kJ·mol-1 SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
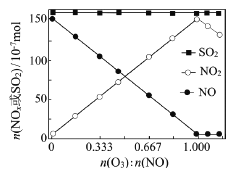
(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是_________________
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是___________________。
(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,溶液(pH约为 8)中SO32-将NO2转化为NO2-,其离子方程式为:_________________________________________________________________________________
(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=_____________________________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是__________________________________________________________________
(5)甲醇燃料电池在碱性溶液中的电极反应式。正极_________________________________;负极____________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
酸 | 电离平衡常数K |
CH3COOH | 1.76×10﹣5 |
H2CO3 | K1=4.3×10﹣7 K2=5.61×10﹣11 |
H3PO4 | K1=7.52×10﹣3 K2=6.23×10﹣8 K3=2.20×10﹣13 |
回答下列问题:
(1)从电离的角度,HCO ![]() 、HPO
、HPO ![]() 、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
、H2PO4﹣都可看作是酸,其中酸性最强的是 , 最弱的是 .
(2)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH= .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学方程式中,属于水解反应的是( )
A.CH3COOH+H2OCH3COO﹣+H3O+
B.HS﹣+H2OS2﹣+H3O+
C.CO2+H2OHCO3﹣+H+
D.CO32﹣+H2OHCO3﹣+OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com