
科目: 来源: 题型:
【题目】用化学反应原理研究氮及其化合物意义重大。请回答下列问题:
(1)已知: N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_______。
(2)T1温度时,在容积为2 L 的恒容密闭容器中发生反应: 2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2 )消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2) ,k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2 )消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2) ,k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
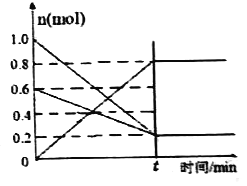
①下列说法能表明该反应已达到平衡状态的是______(填序号)。
A.混合气体的密度不变 B.混合气体的颜色不变
C. k正、k逆不变 D.2v正(O2)= v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系是K=_______。
③T1温度时,化学平衡常数K=______。将容器的温度改变为T2时,若k正=k逆 ,则T2___T1 (填“>”、“<”或“=”)。
(3) 亚硝酸是氮元素重要的含氧酸之一。25℃,测得amol/LHNO2稀溶液的pH=b,该温度下HNO2电离平衡常数的精确计算表达式为K=______(用含a、b的代数式表示)。将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合后,测得溶液pH=7,则溶液中![]() =_____(用含a 的代数式表示)。
=_____(用含a 的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列溶液中,一定能大量共存的一组离子是( )
A. 1.0 mol/L的KOH溶液中:H+、Fe2+、Cl-、SO42-
B. 某无色酸性溶液中:Fe3+、NO3-、Ba2+、H+
C. 加入Al能放出H2的溶液中:Cl-、NO3-、SO42-、NH4+
D. 通入足量CO2的溶液中:H+、NH4+、Al3+、SO42-
查看答案和解析>>
科目: 来源: 题型:
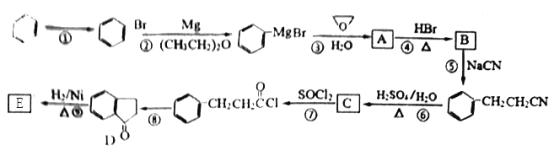
【题目】芳香族化合物E 是合成某种香料的中间体,以苯为原料合成E流程如下:
己知:CH3Br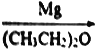 CH3MgBr
CH3MgBr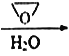 CH3CH2CH2OH
CH3CH2CH2OH
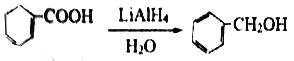
(1)写出反应①所需的试剂和条件_____________。
(2)化合物A的名称是________,分子中不同化学环境的氢原子共有_____种,共面的碳原子数目最多有_______个。
(3)D中含氧官能团的名称是________。
(4)写出反应⑨的化学方程式________,该反应的反应类型是________ 。
(5)化合物C能与Na2CO3溶液反应生成CO2,符合a、b条件的C的同分异构体有多种,其中存在乙基(-CH2CH3),且苯环上的一氯取代物只有两种的同分异构体与足量NaOH溶液反应的化学方程式为___________。
a.属于芳香族化合物 b.能发生银镜反应,也能发生水解反应
(6)在方框中写出以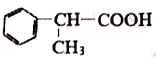 为主要原料,合成
为主要原料,合成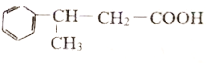 的流程。
的流程。
 ___________
___________
查看答案和解析>>
科目: 来源: 题型:
【题目】KMnO4在生产、生活中用途广泛。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚中混合均匀,小火加热至熔融,可得到K2MnO4,再用镍片(不参与反应) 作阳极,铁片作阴极,电解K2MnO4溶液即可制备KMnO4。上述过程用流程图表示如下:

(1) 制备K2MnO4用铁坩埚不用瓷坩埚的原因是_______,电极室阳离子的迁移方向是_____(填“左侧向右侧迁移”或“右侧向左侧迁移”),阳极室电极反应式为_________,熔融池中的化学方程式为___________。
(2)如下流程也可以制备KMnO4,调节pH用CO2不用HCl的原因是_________,当pH为10~11时,停止通入CO2,原因是_______。(己知:①20℃时,溶解度:K2CO3 111g;KHCO333.7g;KMnO46.3g②温度高于120℃时KMnO4会发生分解反应)

(3)控制烘干温度不能过高的主要原因是_____________。
(4)制得KMnO4的同时会有副产物MnO2生成。副产物MnO2与锂在锂离子有机高聚物中构成原电池。每消耗87gMnO2转移1mole-,则反应后Mn元素的化合价为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A+B3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol/(Ls)
B.v(B)=0.3 mol/(Ls)
C.v(C)=0.8 mol/(Ls)
D.v(D)=1 mol/(Ls)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时,几种常见弱电解质的电离平衡常数如下表所示:
电解质 | H3PO4 | NH3·H2O | C6H5OH |
电离平衡常数 | K1=7.5×10-3 K2=7.5×10-8 K3=7.5×10-13 | 1.7×10-5 | 1.1×10-10 |
下列说法正确的是
A. NaH2PO4溶液呈碱性
B. 25℃时,0.1moL/L氨水的pH=11+lg1.7
C. 足量C6H5OH与Na3PO4反应的离子方程式为:2C6H5OH+PO43-=H2PO4-+2C6H5O-
D. 25℃时,将等体积等浓度的苯酚溶液与氨水混合,混合溶液中各离子浓度关系:c(C6H5O-)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: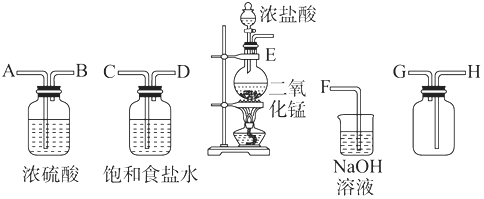
(1)连接上述仪器的正确顺序(填各接口处的字母):接;接;接;接 .
(2)装置中,饱和食盐水的作用是;NaOH溶液的作用是 .
(3)化学实验中常用湿润的淀粉KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到 , 反应方程式 .
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应: .
②NaOH溶液中发生的反应: .
查看答案和解析>>
科目: 来源: 题型:
【题目】冶炼金属一般有下列4种方法:①焦炭法;②水煤气法(或氢气、或一氧化碳)法;③活泼金属置换法;④电解法。4种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜。现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。对它们的冶炼方法的分析不正确的是
A. (Ⅰ)用① B. (Ⅱ)用② C. (Ⅲ)用③ D. (Ⅳ)用④
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为正丁烷的球棍模型。下列说法正确的是( )
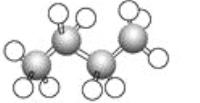
A. 正丁烷的分子式为C4H8
B. 分子中4个碳原子在同一条直线上
C. 分子中含有4个C—C单键
D. 分子中共含有13个共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com