
科目: 来源: 题型:
【题目】(题文)一定温度下,在容积固定的密闭容器中进行的可逆反应:2NO2![]() 2NO+O2,达到平衡的标志是
2NO+O2,达到平衡的标志是
①相同时间内,氧气的生成速率为n mol·L-1·s-1,NO2的生成速率为2n mol·L-1·s-1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化 ④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变 ⑥压强不随时间变化而变化
A. ①③⑤⑥ B. ②③⑤
C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示,已知:物质A、B、C均为气态,D为固态,正反应时吸热反应,根据要求回答下列问题: 
(1)容器中反应的化学方程式为
(2)前2 min,v(A)=mol(minL)﹣1 .
(3)能说明该反应已达到平衡状态的是 .
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T℃时,该反应的平衡常数K=(保留小数点后两位).
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是 (填选项字母).
A.只增加A的物质的量
B.移走一部分D
C.升高反应体系的温度
D.把容器的体积缩小一倍
(6)T℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)v(逆)(填“>”“<”或“=”).
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸参与热化学循环可通过二步循环或三步循环制取氢气,其中三步循环(碘硫热化学循环)原理如下图所示:

(1)“步骤Ⅰ.硫酸热分解”在恒容密闭容器中进行,测得各物质的物质的量分数与温度的关系如下图所示。其在650~1200℃间发生的主要反应的方程式为____。
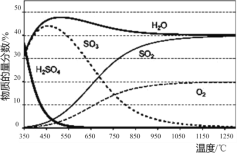
(2)“步骤Ⅱ.硫酸再生”的离子方程式为____(HI是强酸)。
(3)步骤Ⅲ的反应为2HI(g) ![]() H2(g) + I2(g) 。
H2(g) + I2(g) 。
①若在恒温恒容密闭容器中进行该反应,能说明已达到平衡状态的是___(填序号)。
a.容器内气体的总压强不再随时间而变化
b.n(HI)∶n(H2)∶n(I2)=2∶1∶1
c.反应速率:v(H2)正=v(H2)逆
d.I2(g)浓度不再随时间的变化而变化
②已知断裂(或生成)1mol化学键吸收(或放出)的能量称为键能。相关键能数据如下:
化学键 | H—I | H—H | I—I |
键能/kJ·mol-1 | 298.7 | 436.0 | 152.7 |
则该反应的![]() H为____kJ·mol-1。
H为____kJ·mol-1。
(4)将“三步循环”中步骤Ⅱ、Ⅲ用下图装置代替即为“二步循环”。
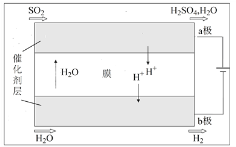
下列有关该装置的相关说法正确的是____(填序号)。
a.化学能转变为电能
b.催化剂可加快电极上电子的转移
c.反应的总方程式为SO2+2H2O ![]() H2+H2SO4
H2+H2SO4
d.每生成1molH2,电路中流过的电子数约为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是世界文明古国,商周时期就制造出了“四羊方尊”、“ 司母戊鼎”等精美青铜器。青铜的主要成分是Cu,还含有少量第ⅣA族的Sn和Pb。回答下列问题:
(1)基态Cu原子的价电子排布图是___________________,基态Sn原子的未成对电子数是Cu的__________倍,Pb位于周期表的______________区。
(2)向CuSO4溶液中加入过量的氨水再加少许乙醇可以析出美丽的蓝色晶体:[Cu(NH3)4]SO4·H2O。
①SO42-中S的杂化方式是___________,晶体所含非金属中电负性最小是__________________。
②请表示出[Cu(NH3)4]2+离子中的全部配位键____________,1mol[Cu(NH3)4]2+中含有_____molσ键。
③水分子的键角为1050,小于NH3分子键角1070,产生此差异的原因是_______________。
(3)铜晶胞模型如图所示: ,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。
,Cu晶胞的棱长为bpm,则1个铜晶胞中Cu原子的质量是____g,1个铜晶胞中Cu原子占据的体积为______________pm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:
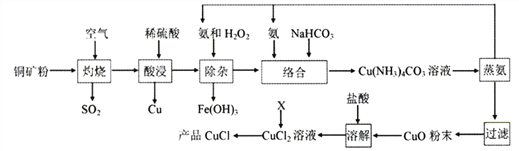
已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)=2×10-7,2Cu+=Cu+Cu2+的平衡常数K1=1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有____________(填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98%H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______。“酸浸”时硫酸不宜过多的原因是__________________。
(3)“除杂”的总反应方程式是_____________________。
(4)“络合”反应中的NH3与NaHCO3理论比值是____________________。
(5)加热“蒸氨”在减压条件下进行的原因是________________。
(6)X可以充分利用流程中的产物,若X是SO2时,通入CuCl2溶液中反应的离子方程式是________________;若X是Cu时,反应Cu+Cu2++2Cl-=2CuCl的平衡常数K2=_________。
(7)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)相同条件下,0.1molL﹣1的NH4Al(SO4)2中c(NH4+)(填“等于”、“大于”或“小于”)0.1molL﹣1NH4HSO4中c(NH4+).
(2)均为0.1molL﹣1的几种电解质溶液的pH随温度变化的曲线如图1所示. 
①其中符合0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是 , 导致pH随温度变化的原因是;
②20℃时,0.1molL﹣1的NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)=(取近似值)
(3)室温时,向100mL0.1molL﹣1NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示: 试分析图中a、b、c、d四个点,水的电离程度最大的是点;在b点,溶液中各离子浓度由大到小的排列顺序是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】利用合成气制备有机中间体B和高分子I的一种合成路线如下(部分反应条件已略去):
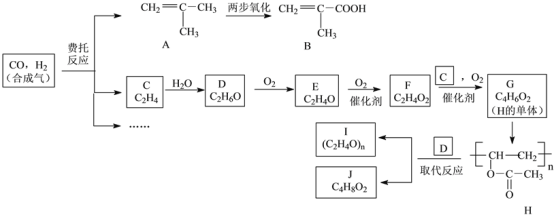
(1)B中所含官能团名称是____和____。
(2)G生成H的反应类型是____。
(3)D生成E的化学方程式为____;实验室由D和F制备J的化学方程式为____。
(4)G的结构简式为____;I的结构简式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2CH4(g)+2NH3(g)+3O2(g)=2HCN(g)+6H2O(g)反应中,已知v (HCN)=n mol/(Lmin),且v(O2)=m mol/(Lmin),则m与n的关系正确的是( )
A.m= ![]() n
n
B.m= ![]() n
n
C.m= ![]() n
n
D.m=2n
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中存在下列平衡:CO(g)+H2O(g)CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( ) 
A.平衡状态A与C相比,平衡状态A的c(CO)小
B.在T2时,若反应处于状态D,则一定有V正<V逆
C.反应CO(g)+H2O(g)CO2(g)+H2(g)的△H<0
D.若T1、T2时的平衡常数分别为K1、K2 , 则K1<K2
查看答案和解析>>
科目: 来源: 题型:
【题目】锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是
A.最高化合价为+2B.原子半径比钠的大
C.单质与水的反应比钠更剧烈D.最高价氧化物对应的水化物碱性比钠的弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com