
科目: 来源: 题型:
【题目】化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( ) 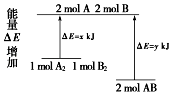
A.该反应的反应热△H=x﹣y kJ/mol
B.断裂1 mol A﹣A键和1 mol B﹣B键放出x kJ能量
C.2 mol AB的总能量高于1 mol A2和1 mol B2总能量
D.该反应是吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中甲和乙均是盐桥原电池装置。请按要求填空
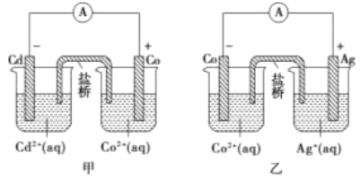
(1)甲中Co电极发生的反应方程式为_____________________________________。
(2)两烧杯中盐桥(填充物为浸有饱和KNO3溶液的琼脂)的作用是__________并使两烧杯中溶液保持电中性。
(3)判断反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能否自发进行并解释理由_________________________。
(4)开始时,乙电池左右烧杯各含100溶液,且Co2+、Ag+浓度均为4mol/L,当有1.204×1022个电子通过外电路时,两烧杯溶液中Co2+、Ag+浓度差为__________(忽略溶液的体积变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】测血钙的含量时,进行如下实验: ①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉徙用稀硫酸处理得H2C2O4溶液.
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2 , 还原产物为Mn2+ .
③终点时用去20mL 1.0×l0﹣4 mol/L的KMnO4溶液.
(1)写出用KMnO4滴定H2C2O4的离子方程式 .
(2)判断滴定终点的方法是 .
(3)③步骤中取酸性KMnO4溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数(填“偏大”、“偏小”或“无影响”).
(4)计算:血液中含钙离子的浓度为mol/L.
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求填空:
(1)①常温下,.某溶液中由水电离出的c(OH﹣)=1.0×10﹣10mol/L,该溶液可以是 . (填选项)
A.pH=4的CH3COOH
B.pH=10的NaOH
C.pH=9的 Na2CO3
D.pH=2的 H2SO4
E.pH=4的 NH4Cl
(2)在100℃时,将 100mL 0.1mol/L 的稀H2SO4溶液与 100mL 0.4mol/L的NaOH 溶液混合后,溶液的pH= . (混合时溶液体积变化忽略不计,己知Kw=10﹣12).
(3)常温下,amL0.1mol/L盐酸与bmL0.1mol/L氨水混合,充分反应,若混合后溶液呈中性,则ab (填“<”、“>”或“=”).
(4)常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,则反应后溶液中离子浓度从大到小的顺序是 .
(5)氯化铝水溶液呈酸性,原因是(用离子方程式表示>: . 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(6)25℃,在0.10mol/LH2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如下图(忽略溶液体积的变化、H2S的挥发). ①pH=13时,溶液中的 c(H2S)+c(HS﹣)=mol/L.
②某溶液含 0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=时,Mn2+开始沉淀.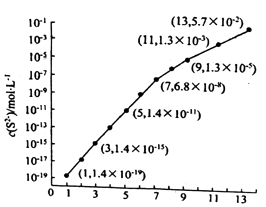
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数值用NA表示。下列说法中正确的是
A. 50 g 46%的乙醇水溶液中含有的氢原子总数为6NA
B. NH4N3(叠氮化铵)发生爆炸:NH4N3![]() 2N2↑+2H2↑当转移4NA个电子时,产生44.8L(标准状况)混合气体
2N2↑+2H2↑当转移4NA个电子时,产生44.8L(标准状况)混合气体
C. 0.1molSO2溶于水,溶液中SO32-、HSO3-、H2SO3的总数为0.1NA
D. 用铂电极电解100 mL 1 mol L-1的CuSO4溶液足够长时间,转移的电子数一定为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】茉酚是一种重要的有机化工原料。利用苯酚合成已二醛[OHC(CH2)4CHO]和尼龙6(![]() )的合成路线如下:
)的合成路线如下:

已知:I.  ;
;
II.  。
。
回答下列问题:
(1)由A制取B的反应类型为_______;C的化学名称为___________。
(2)E的结构简式为____________。
(3)上述流程中合成尼龙6的化学方程式为_____________________。
(4)已二醛与银氨溶液反应的化学方程式为___________________。
(5)已二醛的同分异构休中既含五元环结构,又含“ ” 结构的有_____种(不考虑立体异构);其中核磁共振氢谱有三组峰的结构简式有_________________。
” 结构的有_____种(不考虑立体异构);其中核磁共振氢谱有三组峰的结构简式有_________________。
(6)写出以溴乙烷为原料(其他试剂任选)制备甲醛的合成跻线:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为0.4L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
(1)该反应的△H_______0(填“>”或“<”下同)。
(2)100℃时,体系中各物质浓度随时间变化如图所示。
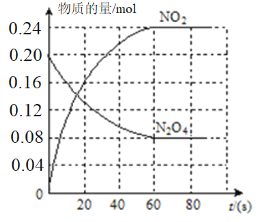
在0~60s时段,反应速率v(N2O4)为__________;反应的平衡常数K的值为_________。反应达平衡后,再向容器中充入0.4molN2O4。平衡向_________(填“正反应”或“逆反应”)方向移动,再次达到平衡时,N2O4的转化率与原平衡相比_________(填“变大”“变小”或“不变”)。
(3)100℃,相同容器中充入2.4molNO2与0.8molN2O4,则反应达平衡之前v正_____v逆。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一个化学过程的示意图. 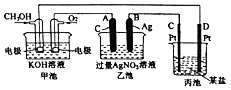
(1)通入O2的电极名称、C(Pt)电极的名称是 .
(2)写出通入O2的电极上的电极反应式是 .
(3)写出通入CH3OH的电极上的电极反应式是 .
(4)若丙池是电解饱和食盐水溶液,则阳极的电极反应为 , 阴极的电极反应为 . 在(阳极或阴极)附近滴入酚酞溶液变红.
(5)乙池中反应的化学方程式为 .
(6)当乙池中B(Ag)极的质里增加5.40g时,甲池中理论上消耗O2mL(标准状况下);若丙池中饱和食盐水溶液的体枳为500mL,电解后,溶液的pH= . (25℃,假设电解前后溶液的体积无变化).
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求回答问题:
(1)相同温度下等物浓度的下列溶液中. A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是(用对应的字母填写).
②NH4+离子浓度由大到小的顺序是(用对应的字母填写).
③若上述溶液的pH值相同,则其物成的量浓度关系是(用对应的字母填写).
(2)25℃.向50mL 0.018molL﹣1 的 AgNO3溶液中加入50mL 0.020molL﹣1的盐酸,生成沉淀.己知该温度下AgCl的Ksp=1.0×10﹣10 , 忽略溶液的体积变化,请计算: ①完全沉淀后,溶液中c(Ag+)= .
②完全沉淀后,溶液的pH= .
(3)弱酸及其盐在水中存在多种平衡关系.己知NaA水溶液呈碱性,常温下将0.1molNaA和0.05molHCl溶于水,得到1L溶液. ①己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为 .
②向该混合物中再加0.03molNaOH,溶液中n(A﹣)+n(OH﹣)﹣n(H+)= .
查看答案和解析>>
科目: 来源: 题型:
【题目】由阿伏伽德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水),不能确定的物理量有( )
A.1摩尔水的质量
B.1摩尔水蒸气的质量
C.1摩尔水的体积
D.1摩尔水蒸气的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com