
【题目】如图是一个化学过程的示意图. 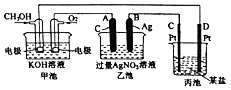
(1)通入O2的电极名称、C(Pt)电极的名称是 .
(2)写出通入O2的电极上的电极反应式是 .
(3)写出通入CH3OH的电极上的电极反应式是 .
(4)若丙池是电解饱和食盐水溶液,则阳极的电极反应为 , 阴极的电极反应为 . 在(阳极或阴极)附近滴入酚酞溶液变红.
(5)乙池中反应的化学方程式为 .
(6)当乙池中B(Ag)极的质里增加5.40g时,甲池中理论上消耗O2mL(标准状况下);若丙池中饱和食盐水溶液的体枳为500mL,电解后,溶液的pH= . (25℃,假设电解前后溶液的体积无变化).
【答案】
(1)正极;阳极
(2)O2+2H2O+4e﹣=4OH﹣
(3)CH3OH+8OH﹣﹣6e﹣=CO32﹣+6H2O
(4)2Cl﹣﹣2e﹣=Cl2↑;2H++2e﹣=H2↑;阴极
(5)2H2O+4AgNO3![]() 4Ag+O2↑+4HNO3
4Ag+O2↑+4HNO3
(6)280;13
【解析】解:燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O,通入氧化剂的电极为正极,正极反应为O2+4e﹣+2H2O=4OH﹣,乙池、丙池是电解池,与电源正极相连的是阳极,与电源负极相连的是阴极,则A是阳极、B是阴极,乙池中阳极、阴极电极反应分别为4OH﹣﹣4e﹣=O2↑+2H2O、Ag++e﹣=Ag,丙池中C是阳极,D是阴极,电解质溶液是氯化钠溶液,氢离子在阴极放电,氯离子在阳极放电.(1)通入O2的电极是正极,C(Pt)电极的名称是阳极,所以答案是:正极;阳极;(2)通入O2的电极上的电极反应式是O2+4e﹣+2H2O=4OH﹣,所以答案是:O2+4e﹣+2H2O=4OH﹣;(3)燃料电池中,通入燃料的电极为负极,电极反应为CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O,所以答案是:CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O;(4)丙池中C是阳极,D是阴极,电解质溶液是氯化钠溶液,氯离子在阳极失电子产生氯气,电极反应为:2Cl﹣﹣2e﹣=Cl2↑,氢离子在阴极得到电子产生氢气,电极反应为:2H++2e﹣=H2↑,水的电离平衡被破坏,氢氧根离子的浓度增大,该区域溶液呈碱性,滴入酚酞溶液变红,
所以答案是:2Cl﹣﹣2e﹣=Cl2↑;2H++2e﹣=H2↑;阴极;(5)乙池中A是阳极、B是阴极,阳极水电离出的氢氧根失电子产生氧气,阴极银离子得电子产生单质银,属于放氧生酸型,电解反应的化学方程式为:2H2O+4AgNO3 ![]() 4Ag+O2↑+4HNO3,所以答案是:2H2O+4AgNO3
4Ag+O2↑+4HNO3,所以答案是:2H2O+4AgNO3 ![]() 4Ag+O2↑+4HNO3;(6)当乙池中B(Ag)极的质量增加5.40g时,根据Ag++e﹣=Ag,转移电子为:
4Ag+O2↑+4HNO3;(6)当乙池中B(Ag)极的质量增加5.40g时,根据Ag++e﹣=Ag,转移电子为: ![]() =0.05mol,根据O2+4e﹣+2H2O=4OH﹣,甲池中理论上消耗O2的体积是:
=0.05mol,根据O2+4e﹣+2H2O=4OH﹣,甲池中理论上消耗O2的体积是: ![]() ×22.4L/mol=0.28L=280mL,产生氢氧根的物质的量为:0.05mol,c(OH﹣)=
×22.4L/mol=0.28L=280mL,产生氢氧根的物质的量为:0.05mol,c(OH﹣)= ![]() =
= ![]() =0.1mol/L,则溶液pH=13,
=0.1mol/L,则溶液pH=13,
所以答案是:280;13.


科目:高中化学 来源: 题型:
【题目】常温下,0.1molL﹣1CH3COONa溶液pH=11,下列表述正确的是( )
A.c(Na+)=c(CH3COO﹣)
B.c(CH3COO﹣)+c(CH3COOH)=0.1 molL﹣1
C.由水电离出来的c(OH﹣)=1.0×10﹣11 molL﹣1
D.往该溶液中加入0.05 molL﹣1的CH3COONa,pH值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的一种新型可充放电AGDIB电池(铝-石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为CxPF6+LiyAl=Cx+LiPF6+Liy-1+Al。放电过程如图,下列说法正确的是( )

A. B为负极,放电时铝失电子
B. 电解液可以用常规锂盐和水代替
C. 放电时A电极反应式为CxPF6+e-=Cx+PF6-
D. 放电时,若转移1mol电子,石墨电极上可增重7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的前36号元素,其中只有两种金属元素。A与C同主族,B与E同主族;B与C能形成两种常见化合物;C与F最外层只有1个电子,且内层均已排满;基态D原子成对电子数是未成对电子数的4倍。
请问答下列问題:
(1)基态B原子的轨道表达式为______,其最高能级的电子云有_____个不同的伸展方向。
(2)B、C、E原子半径由大到小的顺序为_________(用元素符号表示)。
(3)D和E中第一电离能较大的是_______(填元素符号),原因为___________。
(4)A与B形成的最简单化合物比A与E形成的最简单化合物的熔点______(填“高“或“低”),原因为___________。
(5)D的最高价氧化物对应的水化物中,D原子的杂化轨道类型为______,已知该分子中除氢外其他原子均满足最外层8电子稳定结构,则其结构式为________。
(6)单质F及其同族元素P、Q的堆积模型均为面心立方最密堆积,三种原子的半径分别为128pm、144pm、144pm,其中P和Q的相对原子质量分别为Mτ(P)、Mτ(Q)。
①单质F中的配位数为______;密度为_____g/cm3(用NA表示阿伏加德罗常数的值,列式即可)。
②单质P和Q的密度之比为________[用含Mτ(P)、Mτ(Q)的代数式表示]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测血钙的含量时,进行如下实验: ①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉徙用稀硫酸处理得H2C2O4溶液.
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2 , 还原产物为Mn2+ .
③终点时用去20mL 1.0×l0﹣4 mol/L的KMnO4溶液.
(1)写出用KMnO4滴定H2C2O4的离子方程式 .
(2)判断滴定终点的方法是 .
(3)③步骤中取酸性KMnO4溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数(填“偏大”、“偏小”或“无影响”).
(4)计算:血液中含钙离子的浓度为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热). 若增大压强,则平衡常数(填序号). A.一定不变 B.一定减小 C.一定增大 D.增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO)=c(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]镁与铝、锰形成的合金广泛应用于航天、运输、化工等领域。回答下列问题:
(1)基态Mn2+核外电子排布式为_________________。
(2)下列各项比较中,Mg>Al的是____________(填选项序号)。
A.电负性 B.金属键的强弱 C.金属性 D.基态原子第一电离能
(3)叶绿素是以镁离子为中心的卟啉配合物,其结构如图。

①Mg2+与N原子形成的化学键为配位键的是__________(填“a”或“b”)。
②叶绿素分子中C原子的杂化轨道类型有______________。
(4)MgO具有NaCl型结构(如图),MgO晶体的熔点比NaCl高的原因是________________;其中阴离子采用面心立方最密堆积方式,阴离子的配位数为___________,r(O2-)=0.148mm,MgO的密度为___________g/cm3(NA表示阿伏加德罗常数的值,列出计算式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com