
科目: 来源: 题型:
【题目】钛(22Ti)铝合金在航空领域应用广泛,回答下列问题:
(1)基态Ti原子的核外电子排布式为[Ar]_____,其中s轨道上总共有______个电子。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是____,配位体____。
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: n CH3CH=CH2![]()
![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有_______________;反应中涉及的元素中电负性最大的是_________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是____________。
,该反应中涉及的物质中碳原子的杂化轨道类型有_______________;反应中涉及的元素中电负性最大的是_________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是____________。
(4)钛与卤素形成的化合物的熔沸点如下表所示,

分析TiCl4、TiBr4 、TiI4的熔点和沸点呈现一定规律的原因是___________________________。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为 __________________ g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M是四种常见的短周期元素,其中Y、Z、M属于同一周期,X和M属于同一主族,Y元素最外层电子数为1,Z元素核内有14个质子。M和X元素可形成共价化合物MX2,它能使品红溶液褪色。请用化学式或化学用语回答下列问题:
(1)写出X、Y、Z的元素符号:X_______;Y_______;Z_________。
(2)M在周期表的位置是__________________________。
(3)用电子式表示Y2M的形成过程_________________。
(4)原子半径由小到大的顺序是____________________。
(5)四种元素中最高价氧化物对应水化物酸性最强的是 __________。把锌片和铜片用导线连接浸入其稀溶液中(如图所示),则_______是正极,该极发生_______反应,电极反应式为________________。

(6)X、Z、M三种元素的简单氢化物稳定性最强的是_________,其电子式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。该工艺的主要流程如图所示:
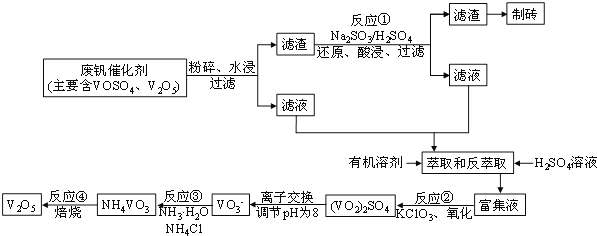
已知部分含钒物质在水中的溶解性如下表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
请问答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其化学方程式可表示为____。
(2)滤液中含钒的主要成分________(写化学式)。反应①的离子方程式___________________。
(3)萃取和反萃取过程中所需的主要玻璃仪器为_____________。若反萃取使用硫酸用量过大,进一步处理会增加_______(填化学式)的用量,造成成本增大。
(4)该工艺反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式___________________。“沉淀”过程中,沉钒率受温度、氯化铵系数(NH4Cl的质量与调节pH之后的料液中VO3-的质量比)等的影响,其中温度与沉钒率的关系如图所示,温度高于80℃沉钒率降低的可能原因是___________________________。

(5)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,③中加入氨水,调节溶液的最佳pH值为____。若矾沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_____。(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(6)废钒催化剂中V2O5的质量分数为6%(原料中的所有钒已换算成V2O5)。取100g此废钒催化剂按上述流程进行实验,当加入105mL 0.1molL-1的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该工业生产中钒的回收率是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25 ℃时, Kb(NH3·H2O)=1.8×10-5。 该温度下,用 0.100mol·L-1 的氨水滴定 10.00 mL 0.100mol·L-1 的一元酸 HA 的溶液, 滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法不正确的是

A. HA 为强酸
B. a=10
C. 25 ℃时,NH4+的水解平衡常数为![]()
D. 当滴入 20 mL 氨水时,溶液中存在 c(NH4+)>c(A-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4 (aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
H2SO4 (aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
C.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定
D.已知I2(g)+H2(g)=2HI(g)△H1<0;I2(s)+H2(g)=2HI(g )△H2<0,则△H1>△H2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A.NaCl 溶液能导电,所以NaCl 溶液是强电解质
B.NaCl晶体不导电,但NaCl 是强电解质
C.液态氯化氢不导电,所以氯化氢是非电解质
D.氯气的水溶液能导电,所以氯气是电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,改变反应物的用量、条件或浓度,不会改变生成物的是
A.钠与氧气反应B.碳酸钠与盐酸溶液反应
C.细铁丝在氯气中燃烧D.二氧化碳与氢氧化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com