
科目: 来源: 题型:
【题目】常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法不正确的是( )
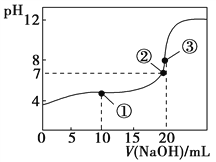
A. 在曲线上任一点均存在:c(Na+)c(OH-) = c(CH3COO-)c(H+)
B. 点①所示溶液中:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+)
C. 点②所示溶液中:c(Na+) = c(CH3COO-)
D. 点③所示溶液中:c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】部分弱酸的电离平衡常数如表所示:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | K=1.77×10-4 | K=6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
下列选项错误的是( )
A. 2CN-+H2O+CO2===2HCN+CO![]()
B. 2HCOOH+CO![]() ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
C. 中和等体积,等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 等体积等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________已知:K300℃>K350℃,则该反应是_______热反应图中表示NO2变化的曲线是__________上述反应在第5s时,NO的转化率为_________。
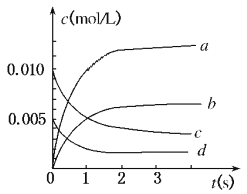
(2)能说明该反应已达到平衡状态的是__________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(![]() )可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。
)可作为火箭发动机的燃料,NH3与NaClO反应可得到肼。
(1)实验室用氯化铵和氢氧化钙制备氨气的化学方程式:__________________
(2)已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-195kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1
写出液态肼和N2O4(l)反应生成N2和水蒸气的热化学方程式:__________________
(3)已知断裂1 mol化学键所需的能量(kJ)如下:N≡N为942、O=O为498、N-N为154、H-O为464、请根据N2H4(l) +O2(g)= N2(g) +2H2O(g) ΔH2=-534kJ·mol-1中数据计算断裂1 molN-H键所需的能量(kJ)是:__________________
(4)写出NH3与NaClO反应得到肼的化学方程式:____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁中发生的基本反应之一:FeO(s)+CO(g) ![]() Fe(s)+CO2(g)(正反应吸热),其平衡常数可表示为
Fe(s)+CO2(g)(正反应吸热),其平衡常数可表示为![]() , 已知1100℃,K=0.263
, 已知1100℃,K=0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值__________(“增大”“减小”或“不变”),平衡常数K值__________(“增大”“减小”或“不变”)。
(2)1100 ℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,在这种情况下,该反应是否处于平衡状态__________(填“是”或“否”),此时,化学反应速率v正__________v逆(填“大于”“小于”或“等于”),其原因是_______________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】对盐类物质可有下列分类:如氯化硝酸钙[Ca(NO3)Cl]是一种混盐,硫酸铝钾KAl(SO4)2是一种复盐,冰晶石(六氟合铝酸钠)Na3AlF6是一种络盐。对于组成为CaOCl2的盐可归类于( )
A. 混盐 B. 复盐 C. 络盐 D. 无法归属于上述类别
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g) ,已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.2 mol·L-1,则平衡时H2的浓度(mol·L-1)是
2HI(g) ,已知H2和I2的起始浓度均为0.1 mol·L-1时,达平衡时HI浓度为0.16 mol·L-1。若H2和I2的起始浓度均变为0.2 mol·L-1,则平衡时H2的浓度(mol·L-1)是
A. 0.16 B. 0.08 C. 0.04 D. 0.02
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某化学课外小组用如右图一装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)观察到A中的现象是_________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡, 写出有关反应的化学方程式 _________________。
(3)C中盛放CCl4的作用是_____________________________________________。
(4)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是 ______________________________。
II.实验室制备硝基苯的主要步骤如下:①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;③在50~60℃下发生反应,直至反应结束;④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净的硝基苯。 请填写下列空白:
(1)配制一定比例浓硫酸和浓硝酸混合酸时,正确操作是___________________________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是_________________________。
(3)步骤④中粗产品用5%NaOH溶液洗涤的目的是 _________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物G分子结构的球棍模型如下图所示(图中小球分别表示碳、氢、氧原子,球与球之间的连线“一”不一定是单键)。用芳香烃A为原料合成G的路线如下:

试回答:
(1)G的分子式为 ____________。
(2)A的结构简式为 ___________;D中官能团的名称为 __________。
(3)B→C反应的化学方程式是 ____________________________。
(4)E的同分异构体中可用通式 表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
表示(其中X、Y均不为H),且能发生银镜反应的物质有______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可)_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com