
科目: 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图转化关系判断下列说法不正确的是(反应条件已略去)
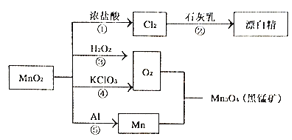
A. 反应①②③④⑤均属于氧化还原反应
B. 生成黑锰矿的反应中,3molMn参加反应转移4mol电子
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应⑤为铝热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列三个反应,判断物质的氧化性由强到弱的顺序正确的是( )
①2Fe3++2I-===2Fe2++I2
②2Fe2++Cl2===2Fe3++2Cl-
③2MnO![]() +10Cl-+16H+===2Mn2++5Cl2↑+8H2O
+10Cl-+16H+===2Mn2++5Cl2↑+8H2O
A. Fe3+>Cl2>MnO![]() B. Fe3+>Cl2>I2 C. I2>Cl2>Fe3+ D. MnO
B. Fe3+>Cl2>I2 C. I2>Cl2>Fe3+ D. MnO![]() >Cl2>Fe3+
>Cl2>Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: (已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
 请回答下列问题:
请回答下列问题:
(1)操作①加热的目的是________________
(2)操作②除用BaCl2溶液外,还可用________。
(3)操作②,判断SO42-已除尽的方法是_____________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是_________。
(5)操作④的名称是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于能量变化的说法正确的是
A. “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B. 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C. 已知C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定
D. 化学反应遵循质量守恒的同时,也遵循能量守恒
查看答案和解析>>
科目: 来源: 题型:
【题目】
有机物G用作有机合成的中间体等,合成G的一种路线如下。

已知:![]()
请回答下列问题;
(1)F的化学名称是________________,①的反应类型是_______________________。
(2)B中含有的官能团是_____________________________(写名称)。
(3)D聚合生成高分子化合物的化学方程式为___________________________________。
(4)反应③的化学方程式是___________________________________。
(5)芳香族化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为___________________________________。
(6)参照有机物G的上述合成路线,设计以M和一氯甲烷为起始原料制备F的合成路线(无机试剂任选) _____________________。
【示例:![]() 】
】
查看答案和解析>>
科目: 来源: 题型:
【题目】在反应mA+nB===pC+qD中,若v(A)=4 mol·L-1·min-1, 而v(B)=1 mol·L-1·min-1,A表示的反应速率比B表示的反应速率快,而m、n符合的关系
A. m∶n=4∶1 B. m∶n<4∶1 C. m∶n>4∶1 D. 无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】“化学是你,化学是我”.化学与生产、生活密切相关,下列说法错误的是( )
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C. 开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D. 二氧化硫有漂白性,常用于棉、麻、纸张和食品的漂白
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与人类的发展密不可分,以下不属于化学对人类贡献的是( )
A.药物和保健品的研制
B.指南针的发明与应用
C.新型高分子化合物的合成
D.合金材料的生产
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液的“溶质质量分数”或溶液的“物质的量浓度”,试求解。
(1)已知某氢氧化钠溶液V L中含有N个氢氧根离子,可求出此溶液的物质的量浓度是________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的溶质的质量分数为________。
Ⅱ.常温下,10.0 mL 1.0 mol·L-1的H2SO4(aq),加水稀释到500 mL,所得H2SO4(aq)的浓度为________mol·L-1;蒸发浓缩,使溶液的体积为2.40 mL,所得H2SO4(aq)的浓度为____mol·L-1。
Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,得到密度为1.19g/mL的盐酸,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为______,该盐酸的浓度为_____(结果均保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com