
科目: 来源: 题型:
【题目】请回答以下问题:
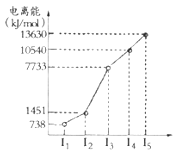
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________。
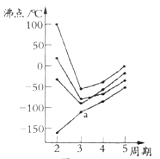
(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______。
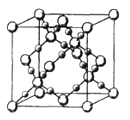
(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________(填“高”或“低”),该晶体中碳原子轨道的杂化类型为______。
(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____(填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________(若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________。
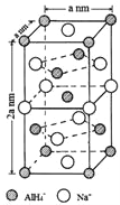
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________个;NaAlH4晶体的密度为___________g·cm-3(用含a的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A. 该反应是吸热反应
B. 该反应是放热反应
C. 铁粉和硫粉在常温下可以发生反应
D. 硫化亚铁的总能量高于铁粉和硫粉的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
科目: 来源: 题型:
【题目】铁的重要化合物高铁酸钾(K2FeO4)是一种新型饮用水消毒剂,具有很多优点。而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为_______________________________;若维持电流强度为1A,电池工作10 min ,理论消耗Zn ___________g(已知F=96500 C/mol)。
(2)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______________________________________。
(3)高铁酸钾生产方法之二是在强碱性介质中用KClO氧化Fe(OH)3生成高铁酸钾,该反应的离子方程式为_______________________________________。
(4)K2FeO4能消毒、净水的原因________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质含有的氧原子数最多的是
A. 80 g O3的气体 B. 0.5 mol CuSO4·5H2O晶体
C. 9.03×1023个CO2分子 D. 标准状况下 67.2 L NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下①13.44 L CH4②6.02×1023个HCl分子③27.2 g H2S ④0.4 mol NH3,下列对这四种气体的关系从大到小表达错误的是
A. 体积②>③>①>④ B. 质量②>③>④>①
C. 密度②>③>④>① D. 氢原子个数①>③>④>②
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应中反应物与生成物有FeCl2、FeCl3、CuCl2、Cu
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
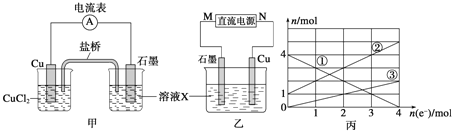
①图中X溶液是______________________;
②Cu电极上发生的电极反应式为_________________;
③原电池工作时,盐桥中的_______________离子(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是___________极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入_________L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示.该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向_____________(填“从a到b”或“从b到a”),负极发生的电极反应式为____________________。

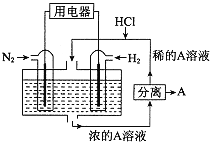
(4)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是_________________________,A是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】将13.0 g锌投入250mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。__
(2)所用盐酸中HCl的物质的量浓度。_____________
(3)需用多少体积的36.5%的浓盐酸(ρ =1.20 g/mL)来配置上述盐酸。_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com