
科目: 来源: 题型:
【题目】工业上采用FeSO4和NaOH为主要原料、在碱性条件下通入空气氧化沉淀制备铁磁粉Fe3O4,其原理如下:
①FeSO4 +2NaOH==Fe(OH)2↓ +Na2SO4
②4Fe(OH)2+O2 +2H2O= =4Fe(OH)3↓
③Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
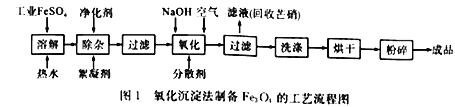
硫酸亚铁在不同温度下的溶解度:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
I.(问题讨论)
(1)溶解时,所用热水的温度约为___________,目的是_______________________________________。
(2)副产品芒硝的化学式是_______________________。
(3)为了检验产品是否洗涤干净,需要进行的实险操作是________________________________。
II.(组成确定)
资料显示:①铁的氯氧化物在受热时分解生成铁的氧化物(化合价不变);
②Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4 ,再生成FeO(黑色),最后生成Fe。
为确定用以上方法制得的产品的纯度,称取23.28g该样品利用图2装置进行实验探究。
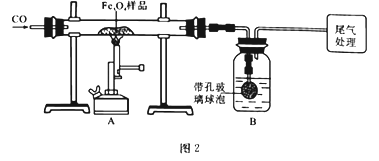
(1)该组同学欲通过称量B装置反应前后的质量变化来计算并确认该样品中的杂质。B中的最佳试剂是________(填字母),B中带孔玻璃球泡的作用是____________________________________。
A.澄清石灰水 B.氢氧化钠浓溶液 C.稀盐酸 D.水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用还有:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,继续通CO气体,防止生成物被氧化,防止B中的溶液倒吸入A中,还可以_______,以提高实验的精确度。
(3)利用仪器测定并绘制出反应过程中A装置中玻璃管内的固体质量随温度的变化曲线,如图3:

①样品中含有的杂质成分是_____________________(填化学式)。
②样品中杂质的质量分数为_____ %(保留2位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2逸出未画出)的物质的量分数随溶液pH变化的部分情况如图所示,下列说法错误的是
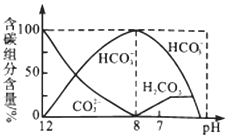
A.在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存
B.已知在25℃,CO32-的水解平衡常数Kh1=2×10-4,当溶液的pH=10时,溶液中c(HCO3-):c(CO32-)=2: 1
C.pH=7时溶液中各种离子其物质的量浓度的大小关系是c(Na+)>c(HCO3-)>c(Cl-)>c(H+)=c(OH-)>c(CO32-)
D.当混合液pH≈6时,开始放出CO2气体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应热和热化学反应的描述中正确的是
A. 1 mol甲烷燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO2(g)![]() 2CO(g)+O2(g) ΔH=+2×283.0 kJ·mol-1
2CO(g)+O2(g) ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)![]() 2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热 ΔH=2×(-57.3) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图所示装置从海水中提取CO2,有利于减少环境中温室气体的含量。下列说法正确的是

A. 通电后,a室的pH增大
B. 中间隔室发生的反应:HCO3-+H+==CO2↑+H2O,从而提取CO2
C. 阴极反应式为2H+-2e-==H2↑
D. 当电路中通过1mol电子的电量时,会有22.4LCO2气体产生
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 分子中含两个一CH3、分子式为C5H11Cl的同分异构体有3种
B. HNO3能与苯、甲苯、甘油、纤维素等有机物发生取代反应
C. 石油裂解的目的是为了提高轻质液体燃料的产量和质量
D. 有机物![]() 的一溴代物有4种
的一溴代物有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式书写错误的是( )
A. NaHCO3水解的离子方程式: ![]() + H2O
+ H2O![]()
![]() +H3O+
+H3O+
B. NH4Cl水解的化学方程式:NH4Cl+H2O![]() NH3·H2O+HCl
NH3·H2O+HCl
C. Al(OH)3的两性电离方程式:H++AlO2+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH
Al3++3OH
D. NaHSO3的电离方程式:NaHSO3![]() Na++
Na++![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯,并证明反应为取代反应。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
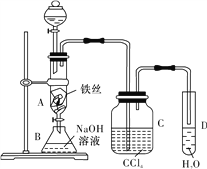
(1)观察到A中的现象是________________,D中导管口可观察到的现象是________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__________________________。
(3)C中盛放CCl4的作用是________________。
(4)若要证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入________溶液,若观察到________________,即能证明。
(5)将锥形瓶中液体分液,得到的溴苯中仍含有杂质________及少量水分,用固体无水硫酸钠等作吸水剂可除去水分,另一种杂质的除去方法是________________(已知溴苯不溶于水,密度大于水,沸点156 ℃)。
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用离子方程式表示盐碱地呈碱性的原因:____________________________________。
(2)已知水存在平衡2H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡________移动,所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡________移动,所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍,稀释后pH仍相等,则m________ n(填“>”“<”或“=”)。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中,由水电离出来的c(OH-)=________mol·L-1。
(5)已知:常温下,NH3·H2O的电离平衡常数Kb=1.75×10-5,H2CO3的电离平衡常数Ka1和Ka2分别为4.4×10-7和5.6×10-11, 依据上述Kb>__________(填“Ka1” 或“ Ka2”)可推知NH4HCO3溶液的酸碱性是________性。
查看答案和解析>>
科目: 来源: 题型:
【题目】美国“9.11”恐怖袭击事件中,毁坏的建筑物发出大量石棉,人吸入石棉纤维易患肺癌。石棉是硅酸盐矿物,某种石棉的化学式为:CaMgxAlySi3O12,该化学式中x、y的值分别是( )
A.2、2B.2、3C.3、2D.4、3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com