
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式__________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)![]() SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol1
3SiH2Cl2(g)![]() SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
SiH4(g)+2SiHCl3 (g) ΔH2=30 kJ·mol1
则反应4SiHCl3(g)![]() SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
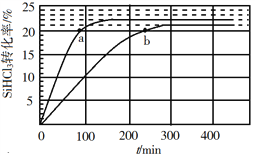
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________;要缩短反应达到平衡的时间,可采取的措施有____________、___________。
③比较a、b处反应速率大小:υa________υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]()
![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础。
(1)钢铁接触海水发生电化学腐蚀,为防止轮船船体被腐蚀,可在船体上安装一定量的____。
A.锌块 B.铜块 C.锡块
(2)有机高分子材料的出现是材料发展史上的一次重大突破。下列物质中含有有机高分子材料的是 _________;
A.普通水泥 B.陶瓷 C.汽车轮胎
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。玻璃是重要的硅酸盐产品,生产玻璃时,石灰石与石英反应的化学方程式是___________
查看答案和解析>>
科目: 来源: 题型:
【题目】为探索工业中含有铝、铁、铜的合金废料的再利用,某同学设计了如下回收方案:

![]() 操作
操作![]() 的名称是___________,滤渣B含有_______________________ (填化学式)。
的名称是___________,滤渣B含有_______________________ (填化学式)。
![]() 合金废料与NaOH溶液反应的化学方程式:____________________________________;
合金废料与NaOH溶液反应的化学方程式:____________________________________;
![]() 反应
反应![]() 的离子方程式是___________________________________;
的离子方程式是___________________________________;
![]() 若要从滤液D中得到绿矾晶体,必须进行的实验操作是_____________、冷却结晶、过滤、洗涤、干燥,在这一系列操作中没有用到的仪器有_________________(填序号)。
若要从滤液D中得到绿矾晶体,必须进行的实验操作是_____________、冷却结晶、过滤、洗涤、干燥,在这一系列操作中没有用到的仪器有_________________(填序号)。
A.漏斗![]() 坩埚
坩埚![]() 烧杯
烧杯![]() 玻璃棒
玻璃棒
![]() 试剂Y应该是一种____________(填“氧化剂”或“还原剂”),它不可能是______(填序号)。
试剂Y应该是一种____________(填“氧化剂”或“还原剂”),它不可能是______(填序号)。
A.H2O2 B.H2 C.O2 D.Fe
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。NH3分子的立体构型是________;N2H4分子中氮原子轨道的杂化类型是________。
(2)与OH-互为等电子体的一种分子为________________(填化学式),N、O、F的第一电离能由大到小的顺序为________________。
(3)在 H2O分子中,H—O—H的键角是________,H+可与H2O形成H3O+,H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用Na2O2与H2O反应快速制取少量O2。用如图所示装置制取O2并进行Na在O2中燃烧的实验。请回答下列问题:

(1)关闭装置中的止水夹a后,开启活塞b,漏斗中的液体不断往下滴,直至全部流入试管。试判断装置是否漏气__________(填“漏气"“不漏气”或“无法确定”),说明理由:_____________________。
(2)写出A装置中所发生反应的化学方程式_______________________________。
(3)C装置中观察到的现象是__________。
(4)D装置中盛放的试剂是__________,其作用是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)实验室由Al盐制备Al(OH)3最佳选择NH3·H2O,其离子反应方程式:____________________________
(2)12.4g Na2X含有0.4mol Na+, Na2X的摩尔质量为________。
(3)由氨气和氢气组成的混合气体的平均相对分子质量为12,则氨气和氢气的物质的量之比为_________
(4)已知![]() 离子可与R2-离子反应,R2-被氧化为R单质,
离子可与R2-离子反应,R2-被氧化为R单质,![]() 的还原产物中M为+3价;又已知100mL c(
的还原产物中M为+3价;又已知100mL c(![]() )=0.2 mol·L-1的溶液可与100mL c(R2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为__________
)=0.2 mol·L-1的溶液可与100mL c(R2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为__________
A.4B.5C.6D.7
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、J是元素周期表前四周期中的五种常见元素。其相关信息如下表:
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | M层上有2对成对电子 |
Z | Z和Y同周期,Z的电负性大于Y |
W | W的一种核素的质量数为63,中子数为34 |
J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是 ______ ;
(2)元素Y位于元素周期表第 ______ 周期第 ______ 族;
(3)元素Z的原子最外层共有 ______ 种不同运动状态的电子;
(4)W的基态原子核外电子排布式是 ____ ,W的基态原子核外价电子排布图是 ______ ;
(5)元素Y与元素Z相比,非金属性较强的是 ______ (用元素符号表示),下列表述中能证明这一事实的是 ______ ;
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
(6)Y、Z两元素的最高价氧化物对应的水化物的酸性较强的是 ______ (用化学式表示);比较下列物质的酸性强弱HZO ______ HZO3。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式:
(1)硫酸铝_________________________。
(2)碳酸氢铵_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com