
科目: 来源: 题型:
【题目】某兴趣小组的同学为了制备氯气并探究其性质,回答下列问题。
Ⅰ.写出实验室制取氯气的离子方程式:_______________________________
Ⅱ.甲同学设计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:

(1)浓硫酸的作用是___________________。
(2)证明氯气和水反应的实验现象为__________。
(3)ICl的性质与Cl2类似,写出ICl与水反应的化学方程式是______________________。
(4)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是______________________。漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,反应的化学方程式是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下有H2RO4=H++HRO4-、HRO4-![]() H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
H++RO42-,现有物质的量浓度都为0.1mol/L的三种溶液:①NaHRO4溶液; ②H2RO4溶液; ③Na2RO4溶液。下列说法正确的是
A. ②和③等体积混合后的溶液中: c( Na+)= c( HRO4-)+c(H2RO4) +c(RO42-)
B. 100mL①溶液中: n(HRO4-)+n(RO42-)+n(OH-)-n(H+)= 0.01
C. ①和②等体积混合后的溶液中可能的离子浓度为c( HRO4-)>c(H+)>c(Na+)
D. 若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度
查看答案和解析>>
科目: 来源: 题型:
【题目】I.近年来,我国储氧纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应的化学方程式为:3C+2K2Cr2O7+8H2SO4(稀)=3CO2+2K2SO4+2Cr2(SO4)3 +4H2O
(1)标出以上化学方程式转移电子的方向和数目___________。
(2)此反应的氧化剂是__________,氧化产物是____________;
(3)上述反应中若产生22g气体物质,则转移电子的数目为___________。
II.用质量分数为36.5%的浓盐酸(密度为1.20 g·cm-3)配制成0.5mol·L-1的稀盐酸。现实验室仅需要这种盐酸250mL,试回答下列问题:
(1)配制稀盐酸时,所需的仪器除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有___________;
(2)此浓盐酸的物质的量浓度是_____________;
(3)经计算需要_______mL浓盐酸;
(4)某学生在上述配制过程中,下列操作会引起浓度偏低的是______________。
A.若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶。
B.定容时,俯视容量瓶的刻度线
C.容量瓶用水洗涤后没有干燥就直接进行配制
D.定容时不小心加水超过刻度线,用胶头滴管取出多余的水,使液面好到达刻度线。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: ![]() ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是
ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是
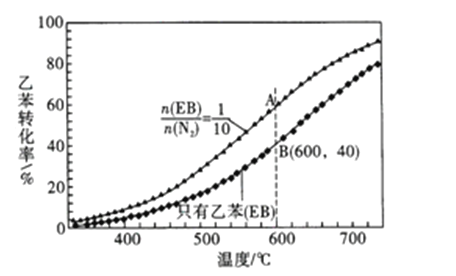
A. 相同条件下,正反应速率: v(A) >v(B)
B. 若在恒容条件下加入稀释剂(N2),能增大乙苯的转化率
C. 若A点乙苯的转化率为60%,则混合气体中苯乙烯的37.5 %
D. 用平衡分压来代替平衡浓度计算,其中分压=总压×物质的量分数,则600℃时,B点的平衡常数Kp=0.019MPa
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修5:有机化学基础]乙基香兰素是最重要的合成香料之一,常作为婴幼儿奶粉的添加剂。制备乙基香兰素的一种合成路线(部分反应条件略去)如下图所示:

已知:① R—ONa + R’—Br —→ R—O—R’ + NaBr
② Ⅲ中生成的Cu2O经氧化后可以循环利用
回答下列问题:
(1)A的核磁共振氢谱有3组峰。A的结构简式为 。
(2)Ⅰ中可能生成的一种烃是 (填名称);催化剂PEG可看作乙二醇脱水缩聚的产物,PEG的结构简式为 。若PEG的平均相对分子质量为17618,则其平均聚合度约为 。
(3)Ⅱ中,发生的反应属于 (填反应类型)。
(4)Ⅲ中,反应的化学方程式为 。
(5)Ⅳ中,有机物脱去的官能团是 (填名称)。
(6)D是乙基香兰素的同分异构体,其分子结构中不含乙基。由A制备D的一种合成路线(中间产物及部分反应条件略去)如下图所示:
C和D的结构简式分别为 、 。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴是人体必需的微量元素,含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用,请回答下列问题:
(1)Co基态原子的电子排布式为_____________;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学中的光敏剂、催化剂等方面得到了广泛的应用,其结构如图所示,中心离子为钴离子。

①酞菁钴中三种非金属原子的电负性有大到小的顺序为_____________,(用相应的元素符号作答);碳原子的杂化轨道类型为_____________;
②与钴离子通过配位键结合的氮原子的编号是_____________;
(3)CoCl2中结晶水数目不同呈现不同的颜色。
CoCl2·6H2O(粉红)![]() CoCl2·2H2O(紫红)
CoCl2·2H2O(紫红)![]() CoCl2·H2O(蓝紫)
CoCl2·H2O(蓝紫)![]() CoCl2(蓝色)
CoCl2(蓝色)
CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用:_____________;
(4)用KCN处理含 Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式:_____________;
(5)Co的一种氧化物的晶胞如图所示( ),在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述 CoO2的化学组成的是_____________。
),在该晶体中与一个钴原子等距离且最近的钴原子有_________个;筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO2的层状结构(如下图所示,小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述 CoO2的化学组成的是_____________。

查看答案和解析>>
科目: 来源: 题型:
【题目】锆(40Zr)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是ZrSiO4,还含有少量A12O3、SiO2、Fe2O3等杂质)为原料生产锆及其化合物的流程如图所示:

(1)SiCl4的电子式为__________。上述流程中,高温气化存在多个反应,若不考虑反应中的损失,则分馏后得到的SiCl4质量通常比由纯ZrSiO4发生的反应得到的SiCl4质量大,原因是___________________________________________________。
(2)高温气化后的固体残渣除C外,还含有的金属元素有________
(3)写出上述流程中ZrCl4与水反应的化学方程式:_____________________。
(4)锆还是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷。下列关于锆、二氧化锆的叙述中,正确的是_____(填序号)。
a.锆合金比纯锆的熔点高,硬度小
b.二氧化锆陶瓷属于新型无机非金属材料
c.将一束光线通过纳米级二氧化锆会产生一条光亮的通路
d.可采用氦作反应堆包裹核燃料的锆合金的冷却剂
(5)工业上电解K2ZrF6与KCl等组成的熔体也可制取金属锆。写出电解的总反应方程式并标明
电子转移的方向和数目 _________________________________________________。
(6)某燃料电池是以C2H4作为燃料气,另一极通入氧气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-,则负极上发生的反应式为_____________________。
(7)极稀溶液中溶质的物质的量浓度很小,常用其负对数pc表示(pcB=-lgcB)。如某溶液中溶质的物质的量浓度为1×10﹣5mol·L﹣1,则该溶液中溶质的pc=5。下列说法正确的是_____
A.电解质溶液的pc(H+)与pc(OH﹣)之和均为14
B.用盐酸滴定某浓度的KOH溶液,滴定过程中pc(H+)逐渐增大
C.BaCl2溶液中逐滴加入硫酸溶液,滴加过程中pc(Ba2+)逐渐减小
D.某温度下Ksp(Zr(CO3)2)=4.0×10﹣12,则其饱和溶液中pc(Zr4+)+ pc(CO32﹣)=7.7
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2SO3![]() HSO3-+H+ Kal;HSO3-
HSO3-+H+ Kal;HSO3-![]() SO32-+H+ Ka2。25℃时,向某浓度的H2SO3溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法错误的是
SO32-+H+ Ka2。25℃时,向某浓度的H2SO3溶液中逐滴滴加一定浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。下列说法错误的是
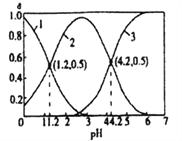
A. 曲线3表示的微粒是SO32-
B. 25℃时,Kal/ Ka2=1000
C. 溶液的pH=1.2时,溶液中有c(Na+)+c(H+)=c(OH-)+c(H2SO3)
D. 溶渡的Ph=4.2时,溶液中有c(Na+)+c(H+)=c(OH-)+2c(SO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够高效低能耗地实现CO2的分离和捕获其原理如下图所示:
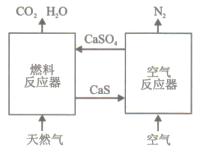
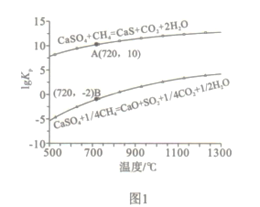
(1)已知在燃料反应器中发生如下反应:
i.4CaSO4(s)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_________(填“i”“ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_______0(填“ >”“ =“或“<” );720℃时反应ⅲ的平衡常数Kp=________。
③下列措施可提高反应ii中甲烷平衡转化率的是_______。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃ -900℃之间,从化学反应原理的角度说明原因:_______。
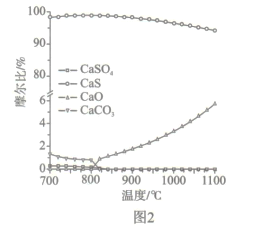
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为__________反应。
②在天然气燃烧过程中,可循环利用的物质为________。
(4)该原理总反应的热化学方程式为____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com