
科目: 来源: 题型:
【题目】磷的单质和化合物在科研与生产中有许多重要用途。请回答下列问题:
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____对成键电子对和____对孤电子对。

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为_______。但NCl5不存在,其原因是________________________;
(3)电负性比较:P_____S(填“>”“=”“<”);而P的第一电离能比S大的原因是______。
(4)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。

直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:_______;含3个磷原子的环状偏磷酸盐的酸根离子(图c)的化学式为________。
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
①与Ga紧邻的P个数为________。
②GaP晶体的密度为(列出计算式)______g·cm-3(NA为阿伏加德罗常数)。

查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理氮氧化物。
Ⅰ.已知:

(1)写出反应1的离子方程式___________。
(2)在反应2中,NO2-的初始浓度为0.1mol·L-1,反应为NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。

①比较a、b点的反应速率:va逆_______vb正(填或“>”“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K______(填“增大”、“不变”或“减小”)。
③已知90℃时,Kw=3.6×10-13,若b点对应的pH为12,则该温度下K=_____(保留一位小数)。
(3)工业电解硫酸钠和硫酸的混合液制备过硫酸钠(Na2S2O8),阳极的电极反应式为_______。
Ⅱ.N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) ΔH。
回答下列问题:
(4)已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) ΔH1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH2
ΔH=_____。(含ΔH1、ΔH2的代数式)
(5)某温度下,测得c(N2O)随时间t变化关系如图所示。
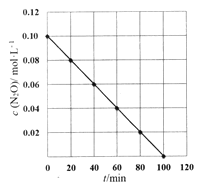
己知瞬时反应速率v与c(N2O)的关系为v=kcn(N2O)(k是反应速率常数),则k=________,n=_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为_________、_________;滤渣①的主要成分为__________。

(2)Co2O3与浓硫酸反应生成CoSO4,化学方程式为______________________________。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,离子方程式为____________________________________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____________mol·L-1 (取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11,Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________。
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______(产率=![]() )。
)。
查看答案和解析>>
科目: 来源: 题型:
【题目】今有Ba(NO3)2、AgNO3、Fe(NO3)3的混合液。欲将Ba2+、Ag+、Fe3+分离,分别得到三种元素的不溶物,按下图所示实验:
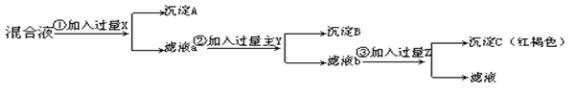
⑴加入的试剂分别是:X________,Y_________,Z_________。
⑵生成的沉淀A是__________,B是___________,C是___________。
⑶第②步和第③步的离子方程式分别是________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。

已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是
A. 曲线m表示pH与lg![]() 的变化关系
的变化关系
B. 当溶液呈中性时,c(Na+)=![]() +2
+2![]()
C. Ka1(H2CO3)=1.0×10-6.4
D. 25℃时,CO32-+H2O![]()
![]() +OH-的平衡常数为1.0×10-7.6
+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活、生产、环境等社会实际密切相关.下列叙述正确的是( )
A. 稀的食盐水能杀死H7N9禽流感病毒
B. 涤纶、塑料、光导纤维都是有机高分子材料
C. 用电镀厂的废水直接灌溉农田,可提高水的利用率
D. 外形似海绵、密度小、有磁性的碳与石墨互为同素异形体
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量浓度相同的NaCl、MgCl2、AlCl3三种物质的溶液,当溶液的体积比为3∶2∶1 时,它们与同一浓度的AgNO3溶液恰好反应,则消耗的AgNO3溶液的体积比是
A. 3∶4∶3 B. 1∶1∶1 C. 1∶2∶3 D. 3∶2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】向200 mL 某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2 ,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2 mol∕L的盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
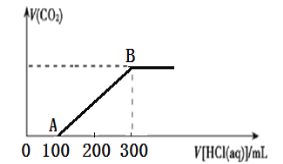
(1)OA段、AB段发生反应的离子方程式:_____________________、___________________。
(2)B点时,反应所得溶液中溶质的物质的量浓度是_____________。
(3)原NaOH溶液的物质的量浓度是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是
A. 0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl与0.l mol·L-1氨水等体积混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com