
科目: 来源: 题型:
【题目】下列除去杂质的方法中错误的是( )
物质 | 杂质 | 除杂质的方法 | |
A | SiO2 | CaCO3 | 过量稀硫酸、过滤 |
B | 铜粉 | 铝粉 | 过量CuCl2溶液、过滤 |
C | FeCl3溶液 | FeCl2 | 通入适量氯气 |
D | SO2 | HC1 | 通过NaHSO3溶液的洗气瓶 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | NaHCO3(Na2CO3) | 适量盐酸 | 蒸发结晶 |
B | CO2(CO) | O2 | 点燃 |
C | Mg(Al) | 氢氧化钠溶液 | 过滤 |
D | CO2(HCl) | 氢氧化钠溶液 | 洗气 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2-硝基-1,3-苯二酚是橘黄色固体,易溶于水、溶液呈酸性,沸点为88℃,是重要的医药中间体。实验室常以间苯二酚为原料分以下三步合成:

具体实验步骤如下:
①磺化:称取5.5g碾成粉状的间苯二酚放入烧杯中,慢慢加入浓硫酸并不断搅拌,控制温度为60~65℃约15min。
②硝化:将烧杯置于冷水中冷却后加入混酸,控制温度(25±5) ℃左右继续搅拌15min。
③蒸馏:将反应混合物移入圆底烧瓶B中,小心加入适量的水稀释,再加入约0.1g尿素,然后用下图所示装置进行水蒸气蒸馏;将馏出液冷却后再加入乙醇-水混合剂重结晶。
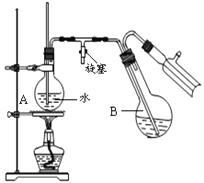
回答下列问题:
(1)实验中设计Ⅰ、Ⅲ两步的目的是__________________________。
(2)硝化步骤中制取“混酸”的具体操作是_________________________________________。
(3)写出步骤Ⅱ的化学方程式__________________________________________________.
(4)烧瓶A中玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能_____________.
(5)步骤②的温度应严格控制不超过30℃,原因是_________________________。
(6)步骤③所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇-水混合剂洗涤。请设计简单的实验证明2-硝基-1,3-苯二酚已经洗涤干净:__________________________________________________。
(7)本实验最终获得1.55g橘黄色固体,则2-硝基-1,3-苯二酚的产率约为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有色透明溶液中,一定能大量共存的是( )
A.含有0.1mol/L Ba2+的溶液中:Na+、K+、HCO3-、Cl-
B.在氨水中:K+、Cu2+、Cl-、SO42-
C.强酸性溶液中:Fe3+、MnO4-、SO42-、K+
D.强酸性溶液中:Na+、Fe2+、Cr2O72-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】【题目】有机物E是医药合成中间体.其合成路线如图:
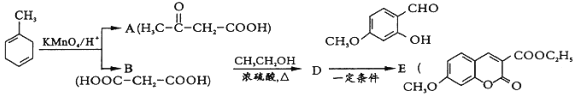
(1)![]() 的官能团名称为______.
的官能团名称为______.
(2)已知![]() 的系统命名为 2-丙酮酸,则A的名称是________________.
的系统命名为 2-丙酮酸,则A的名称是________________.
(3)D为二元酯,则B→D的化学方程式为________________________________________.
D→E的反应历程如图:

(4)写出这几步的反应类型:I_____________,Ⅱ____________III____________
(5)![]() 中能与稀 NaOH溶液反应的官能团是______.检验该官能团的方法是__________________________________________.
中能与稀 NaOH溶液反应的官能团是______.检验该官能团的方法是__________________________________________.
(6)写出满足下列条件的D的所有同分异构体的结构简式______________________________.
a.核磁共振氢谱有3组峰
b.常温下能与NaHCO3按1:2反应并释放出气体
(7)由化合物A经过两步便可以合成环境友好型高聚物聚3-羟基丁酸酯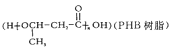
请写出反应合成线路,结合已知信息选用必要的无机试剂,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。
②取一滴定管依次用自来水、蒸馏水洗净后,再用0.01mol·L-1 Na2S2O3溶液润洗,然后装入0.01mol·L-1 Na2S2O3溶液到0刻度以上,排出下端尖嘴内的气泡,调整液面至0刻度或0刻度下某一位置,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6。试回答下列问答:
(1)步骤①加入的指示剂是_______________________________。
(2)步骤②应使用________式滴定管。
(3)判断达到滴定终点的实验现象是___________________________________。
Ⅱ.(4)若用0.1032 mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是____________。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定时将标准液溅出锥形瓶外
(5)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4 K1=5.9×10-2,K2=6.4×10-5。0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH(选填“大于”、“小于”或“等于”)。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3) >c(HCO3-)>c(HC2O4-)>c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β—羰基酯,同时失去一分子醇,该反应称克莱森(R·L·Claisen)酯缩合反应,其反应机理如下:2RCH2COOC2H5![]()
 +C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:
+C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:

回答下列问题:
(1)A的名称为__________,C的结构简式为__________。
(2)F中含氧官能团的名称是__________;反应Ⅱ的反应类型是__________。
(3)E→F反应的化学方程式为_________________________________。
(4)B的含有苯环的同分异构体有_____________种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为__________、__________。
(5)乙酰乙酸乙酯( ![]() )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物Ⅳ为一种重要化工中间体,其合成方法如下:

(1)化合物III的分子式为_______________
(2)写出化合物I在NaOH醇溶液中反应的化学方程式(注意:由于生成互为同分异构体的两种有机物,写出任意一种作为生成物即可)____________________________________________
(3)写出化合物Ⅱ与新制的氢氧化铜反应的化学方程式___________________________。
(4)化合物IV在浓硫酸催化下反应生成六元环状酯类化合物,写出该物质的结构简式_________。
(5)根据题给化合物转化关系及相关条件,请你推出![]() (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为_______、_______,它们物质的量之比是_________。
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为_______、_______,它们物质的量之比是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.高铁酸钾( K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置:
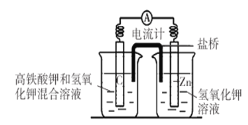
(1)该电池放电时正极的电极反应式为_________________________________________;若维持电流强度为1A,电池工作十分钟,理论消耗Zn_______g(已知F=96500C/mol,小数点后保留1位)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向_______移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向_______移动(填“左”或“右”)。
(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有____。
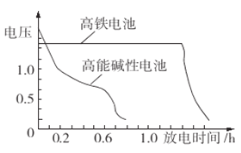
Ⅱ.工业上湿法制备K2FeO4的工艺流程如图。
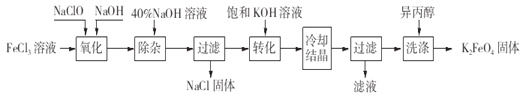
(4)完成“氧化”过程中反应的化学方程式:___FeCl3+___NaOH+___NaClO=___Na2FeO4+___NaCl+___H2O,其中氧化剂是_______(填化学式)。
(5)加入饱和KOH溶液的目的是_____________________。
(6)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入_______mL 2 mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com