
科目: 来源: 题型:
【题目】将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL2mol/LNaOH溶液完全吸收,生成NaNO3和NaNO2的混合溶液,其中生成的NaNO3的物质的量为( )
已知NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH= NaNO3+NaNO2+H2O,
A. 0.2mol B. 0.4mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示。W、X、Y、Z原子的最外层电子数之和为21。下列说法中错误的是( )
![]()
A. 元素X的单质能与强酸、强碱反应B. 元素W、X与钠元素可形成化合物Na3XW6
C. 气态氢化物的稳定性:W>YD. 简单阴离子的还原性:W>Z
查看答案和解析>>
科目: 来源: 题型:
【题目】X和Y的原子序数都小于18,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
A. n+11 B. n-5 C. n+3 D. n-6
查看答案和解析>>
科目: 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将![]() 转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
阳离子 | Fe3+ | Fe2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 9(>9溶解) | 8 |
(1)某含铬废水处理的主要流程如下图所示:

①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______________________________。
②请补充并配平以下反应池中发生主要反应的离子方程式:____![]() +____
+____![]() +____===____Cr3++____
+____===____Cr3++____![]() +____H2O。
+____H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-===H2O和_______________________________。证明Cr3+沉淀完全的方法是_____________________________________________________________。
(2)工业可用电解法来处理含![]() 的废水。实验室利用如图模拟处理含
的废水。实验室利用如图模拟处理含![]() 的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。

①Fe2+与酸性溶液中的![]() 反应的离子方程式是______________________________。
反应的离子方程式是______________________________。
② 若溶液中含有0.01 mol ![]() ,则阳离子全部生成的沉淀的物质的量是______mol。
,则阳离子全部生成的沉淀的物质的量是______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
A. 达平衡时间甲比乙短
B. 乙容器中再充入等物质的量的SO2和O2,重新达平衡时转化率减小
C. 达平衡时,甲中SO2的浓度比乙中SO2的浓度大
D. 达平衡时,甲的转化率比乙低
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是

A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验验证反应得到的混合气体中含有SO2、H2、H2O
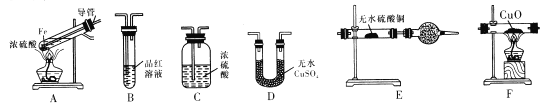
已知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________。
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→______(不可重复使用)。
(3)A中导管的作用为_____,装置E中的干燥管中盛放的物质为碱石灰,其作用是_______。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:
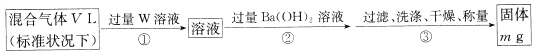
(5) W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为_____________(用含V、m的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(Ⅰ)氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
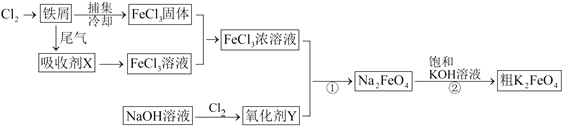
请回答下列问题:
(1)吸收剂X的化学式为__________,氧化剂Y的化学式为________。
(2)碱性条件下反应①的离子方程式为_____________。
(3)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___(填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
(Ⅱ)日常生活和生产与化学紧密相连。
(1)“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。所谓“纳米材料”是指研究、开发出的微粒粒度从几纳米至几十纳米的材料,如将纳米材料分散到分散剂中,所得混合物可能具有的性质是 ______。
A.能全部透过半透膜B.有丁达尔效应
C.所得液体不稳定,会分层D.所得物质一定是悬浊液
(2)把淀粉溶液溶于沸水中,制成淀粉胶体,回答下列问题:
①可以利用 ______ 鉴别水溶液和胶体。
②60℃左右时,在淀粉胶体中加入淀粉酶,装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸镏水的烧杯里充分反应,从半透膜里析出的物质是 ______ ,该操作的名称是 ______。
(3)生活和生产中常用到胶体的性质,请看下述几例:
①手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是 ______。
②水泥和冶金工厂常用高压电对气溶胶作用以除去大量烟尘,减少对空气的污染,这种作用运用了 ______ 原理。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com