
科目: 来源: 题型:
【题目】科学的进步离不开技术的突破。原子光谱核磁共振、X射线行射、量子计算等技术的发展与应用都推进了结构的研究。如过渡元素原子结构、超分子结构、晶体结构、配合物结构研究等。
(1)过渡元素Cr原子的基态电子排布式为______,Cr的核外电子由激发态跃迁至基态时产生的光谱是______ (填“吸收”或“发射”)光谱。
(2)胍鎓离子[C(NH2)3+]可以与甲基磺酸根(CH3SO3-)形成超分子晶体,其局部结构如图所示。

①组成该晶体的元素中电负性最大的是______,其中S的杂化类型有_______。
②元素C、N、S的简单氢化物在水中的溶解度从小到大的顺序为______,原因是______。
(3)①将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)4]2+→Cu(OH)2→[Cu(NH3)4]2+。[Cu(H2O)4]2+和[Cu(NH3)4]2+中共同含有的化学键类型有_________。
②已知:AlF63+在溶液中可稳定存在,CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_____(用离子方程式表示)。
(4)近年研究人员通过量子化学计算预测并合成了化合物Na2He,经X射线行射分析其晶胞结构如图所示。

①晶胞中Na堆积形成___________(填形状)空间结构,He占据一半空隙,另一半由e-占据。已知Na2He晶体不能导电,理由是__________。
②已知晶胞边长为anm,晶胞中Na的半径为bnm,则He的半径为_____nm(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:O2(g)+S(s)=SO2(g)△H=一akJ/mol
O2(g)+2SO2(g)![]() 2S03(g)△H=-bkJ/mol
2S03(g)△H=-bkJ/mol
写出SO3(g)分解生成O2(g)与S(s)的热化学方程式:_______________________。
(2)研究SO2催化氧化生成SO3的反应,回答下列相关问题:
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到平衡时,用SO2表示的平均反应速率为_________。

②在一容积可变的密闭容器中充入20molSO2(g)和10molO2(g),02的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P2_____P1(“>”“<”或“=”),A、B、C三点的平衡常数大小关系为______(用K、Kg、K。和“<”“>”或“=”表示)。
(3)常温下,H2SO3的电离平衡常数Ka1=1.5510-2Ka2=1.02×10-7。
①将SO2通入水中反应生成H2SO3。试计算常温下H2SO3![]() 2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
②浓度均为0.1mol/L的Na2SO3、NaHSO3混合溶液中,![]() =______________。
=______________。
(4)往1L0.2mol/LNa2SO3溶液中加入等体积的0.1mol/L的CaCl2溶液,充分反应后(忽略溶液体积变化),溶液中c(Ca2+)=______。(已知,常温下Ksp(CaSO3)=1.28×10-9)
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3 与稀硫酸反应的化学方程式为__________________________。
(2)加入H2O2 氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
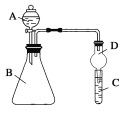
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是___________(填化学式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:______与盐酸反应最剧烈,________ 与盐酸反应的速度最慢。实验结论为:_____________________________。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________________。
Ⅱ. 利用下图装置可验证同主族元素非金属性的变化规律。
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液_____________________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有_________溶液的洗气瓶除去。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用 元素符号或化学式 填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是_________,其离子的原子结构示意图为_____________
(2)①~⑩元素中,最不活泼的元素是____________,元素的最高价氧化物对应的水化物中酸性最强的酸是___________, 碱性最强的碱是_____________,呈两性的氢氧化物是
(3)按要求填写: ①的氢化物的电子式__________________;用电子式表示 ③和⑦形成化合物的形成过程__________________________________________;
(4)② ⑦和⑩的单质的氧化性由强到弱顺序是_________________________________,可用说明⑦和⑩的单质氧化性强弱的反应事实是(用化学反应方程式表示):__________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素,已知Se的原子结构示意图如图:下列说法不正确的是

A. 该原子的质量数为34
B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性
D. 酸性:H2SO4>H2SeO4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
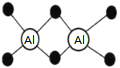
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
查看答案和解析>>
科目: 来源: 题型:
【题目】若图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。

下列各表述与示意图一致的是
A. 图①三种离子的物质的量之比为:n(Mg2+):n(Al3+):n(NH4+)=2:3:2
B. 图①中使用的NaOH的浓度为2mol/L
C. 图②中物质A反应生成物质C,△H>0
D. 图②中曲线表示某反应过程的能量变化。 若使用催化剂,B点会降低
查看答案和解析>>
科目: 来源: 题型:
【题目】将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.8mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A. 21.2g B. 6.2g C. 8.4g D. 10.6g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 水的电离方程式:H2O = H++ OH-
B. pH=7的溶液一定是中性溶液
C. 升高温度,水的电离程度增大
D. 将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com