
科目: 来源: 题型:
【题目】下列说法正确的是
A. 用湿润的pH试纸测定NaCl 溶液的pH时会影响测定结果
B. 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝
C. 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中
D. 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小
查看答案和解析>>
科目: 来源: 题型:
【题目】若N60与C60结构相似的另一种“足球分子”,则下列说法正确的是
A. N60分子中只含有共价键 B. N60和14N都是氮的同位素
C. N60是一种新型化合物 D. N60与C60互为同素异形体
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在试管Ⅰ和Ⅱ中分别加入3mL稀盐酸(均足量),再将装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口。各将气球内的NaHCO3、Na2CO3同时倒入试管中,回答:
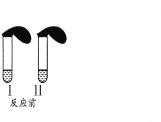
①I试管发生的离子方程式: _______________________;
②两支试管中充分反应后生成的气体总量Ⅰ_____Ⅱ,反应结束时消耗盐酸的物质的量Ⅰ_____Ⅱ(填“>”“=”或“<”)。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。乙同学认为甲同学的判断太武断,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
4 | 35mL稀盐酸 | 含3.2gNa2CO3饱和溶液15mL[来 | 20℃ | 24.2℃ |
5 | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | T℃ |
6 | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出:
①Na2CO3的饱和溶液和盐酸的反应是___________(吸热或放热)反应;
②NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
③表中⑤号试验混合后温度T℃可能是(填编号)_________________________。
A.18.5℃ B. 24.2℃ C.16.2℃
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 天然气和沼气的主要成分都是甲烷,它们都属于不可再生能源
B. 煤的气化和液化均属于物理变化
C. 石油裂解的目的是为了得到更多的汽油
D. 用含糖类、淀粉比较多的农作物为原料,在催化剂作用下,经水解和细菌发酵制乙醇的过程属于生物质能的利用
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A是黄绿色气体、B、H是无色无味气体。(反应中生成的水已略去)

请回答以下问题:
(1)A是________,H是________。(填化学式)
(2)C物质在日常生活中可作________剂。
(3)F分子所含共价键类型是________;写出B的电子式_________。
(4)写出反应①的化学方程式:____________________________;写出反应③的离子方程式:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,3molX与3molY在恒容密闭容器中发生反应X(g)+3Y(g)![]() 2Z(g),△H=-Q kJ·molˉ1(Q>0)下列说法正确的是
2Z(g),△H=-Q kJ·molˉ1(Q>0)下列说法正确的是
A. 达到平衡时,反应放出QkJ热量
B. 反应一段时间后,X与Y的物质的量之比仍为1:1
C. X的体积分数不变,说明反应已达到平衡状态
D. 达到平衡后,若向平衡体系中充入氦气,Z的反应速率不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,水作还原剂的是
A. 2H2O+2F2=4HF+O2 B. 2Na2O2+2H2O=4NaOH+O2↑
C. 2Na+2H2O=2NaOH+H2↑ D. 2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶波中加入铝粉能产生氢气,则该溶液中不可能大量共存的一组离子是
A. K+、Cl-、H+ B. NH4+、NO3-、SO42- C. K+、A13+、Br- D. Na+、K+、SiO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。请填写下列空白。
(1)E元素基态原子的核外电子排布式为______。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为______(填元素符号),其原因为__________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为______;1 mol B2A4分子中含______ mol σ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为______,乙为______;高温时,甲易转化为乙的原因为______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com