
科目: 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx―→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为____。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。

装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:____。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为___。
(5)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次增大,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层龟子数是次外层电子数的3倍。
(1)试推断它们各是什么元素? 按要求写出合适的化学用语:A的元素符号:______,C单质的电子式:_________________,用电子式表示D的简单氢化物的形成过程________。
(2)甲、乙、丙、丁是由以上四种元素中的几种组成的10 电子微粒;
①甲为分子,且为天然气的主要成分,则甲的化学式为______
②乙为气体,且遇到无色酚酞溶液变成红色,则乙的电子式为_______
③丙为阳离子,丁为阴离子,且丙和丁在加热条件下生成的两种物质也是10电子微粒,请写出该反应的离子方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物X的合成路线如下图所示。请回答下列问题:
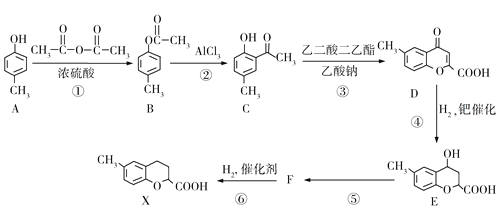
(1)A的名称是________________,X的分子式为_____________。
(2)B的核磁共振氢谱中所有峰的面积之比是________________。
(3)有机物D中含氧官能团的名称是________________,④的反应类型为________________。
(4)反应①的化学方程式为________________________________。
(5)有机物F的结构简式为________________________________。
(6)满足下列条件的C的同分异构体有_____种,任写出其中一种的结构简式_________。
①苯环上只有三个取代基;
②能与三氯化铁溶液反应显色;
③可以发生银镜反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子,能大量共存的是
A.Fe3+、Na+、OH-、Cl-B.Ag+、K+、Cl-、NO3-
C.CO32-、H+、Ca2+、Cl-D.Na+、Cl-、OH-、K+
查看答案和解析>>
科目: 来源: 题型:
【题目】把a、b、c、d四块金属片浸在稀硫酸中,用导线两两连接可以组成原电池,若a、b相连时a为负极;a、c相连时c极上产生大量气泡;b、d相连时b极发生还原反应;c、d相连时,电流由d到c。则这四种金属的活动性顺序由大到小为:( )
A. a>c>d>bB. a>b>c>dC. c>a>b>dD. b>d>c>a
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关生活中常见的物质,说法正确的是( )
A. 苯分子中的化学键是单双键交替结构 B. 聚乙烯能和溴水发生加成反应
C. 所有的糖类都能水解 D. 75%的酒精可以用于医疗杀菌消毒
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8 ℃,42 ℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。
(制备产品)
将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。

(1)各装置的连接顺序为___→___→___→________→____。___________
(2)装置B中多孔球泡和搅拌棒的作用是_;装置C的作用是__。
(3)制备Cl2O的化学方程式为___。
(4)反应过程中,装置B需放在冷水中,其目的是___。
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是____。
(测定浓度)
(6)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定装置E所得溶液中次氯酸的物质的量浓度:量取10 mL上述次氯酸溶液,并稀释至100 mL,再从其中取出10.00 mL于锥形瓶中,并加入10.00 mL 0.80 mol·L-1的FeSO4溶液,充分反应后,用0.050 00 mol·L-1的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00 mL,则原次氯酸溶液的浓度为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。请回答下列问题:
Ⅰ.已知:①2Cu2S(s)+3O2(g) ![]() 2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
2Cu2O(s)+2SO2(g) ΔH=768.2kJ·mol1
②Cu2S(s)+O2(g)![]() 2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
2Cu(s)+SO2(g) ΔH=217.4 kJ·mol1
(1)Cu2S与Cu2O反应生成Cu和SO2的热化学方程式为____________,该反应中Cu2O作_________(填“氧化剂”或“还原剂”)。
Ⅱ.Cu2O可催化二甲醚合成乙醇。
反应①:CH3OCH3(g)+CO(g)![]() CH3COOCH3(g) ΔH1
CH3COOCH3(g) ΔH1
反应②:CH3COOCH3(g)+2H2(g)![]() CH3OH(g)+C2H5OH(g) ΔH2
CH3OH(g)+C2H5OH(g) ΔH2
(2)压强为p kPa时,同一体系中发生反应①和反应②,温度对二甲醚(CH3OCH3)和乙酸甲酯(CH3COOCH3)平衡转化率的影响如图1所示,则ΔH1______0(填“>”或“<”,下同)、ΔH2______0。温度对平衡体系中乙酸甲酯的百分含量和乙醇的百分含量的影响如图2所示。在300~600 K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________。
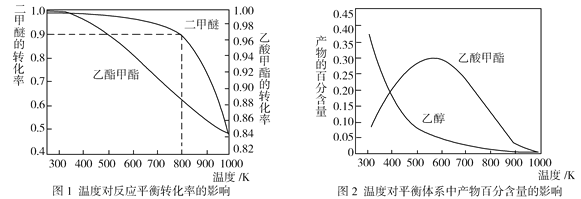
(3)若压强为p kPa、温度为800 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3和1 mol CO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为_________,该条件下平衡常数K=_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年科幻片《流浪地球》中有个画面,冰原上是身穿“核电池全密封加热服”的人类,一旦被卸下核电池,人类就被冻僵,该装置提供电能,并将电能转化为 ( )
A.化学能B.热能C.生物质能D.动能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com