
科目: 来源: 题型:
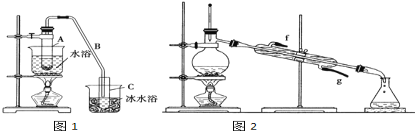
【题目】化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯。
已知:
相对分子质量 | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 100 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 82 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品:
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是_________.
②试管C置于冰水浴中的目的是____________________________.
(2)制备精品:
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静止、分层,环己烯在______层(填“上”或“下”),分液后用_______(填选项字母)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图2装置蒸馏,蒸馏时要加入生石灰,目的是__________________________.
③蒸馏收集产品时,实验制得的环己烯精品质量低于理论产量,可能的原因是_______(填选项字母).
a. 蒸馏时从70℃开始收集产品 b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出。
(3)以下区分环己烯精品和粗品的方法,合理的是_______(填选项字母)。
a. 分别加入用金属钠 b. 分别加入酸性高锰酸钾溶液
c. 分别测定沸点 d. 分别加入FeCl3溶液
(4)如果最终得到纯净环己烯产品质量为8.2 g, 则该实验所得到的环己烯产率是___________(保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g) ΔH =QkJ/mol(Q>0),则下列说法正确的是
2SO3(g) ΔH =QkJ/mol(Q>0),则下列说法正确的是
A. 2 molSO2(g)和1 mol O2(g)具有的能量小于2molSO3(g)具有的能量
B. 2molSO2(g)和1molO2(g)置于密闭容器中充分反应放出QkJ的热量
C. 2mol SO2(g)和1molO2(g)置于密闭容器中充分反应放出热量大于QkJ
D. 如将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热量QkJ,则此过程中有2 mol SO2(g)被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填写:
(1) 的名称(系统命名法)是________________________
的名称(系统命名法)是________________________
(2)4—甲基—2—戊烯的结构简式是__________________________
(3)相对分子质量为72且沸点最低的烷烃的结构简式是_____________________
(4)合成高聚物![]() 其单体的结构简式是______________________
其单体的结构简式是______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法不正确的是

A. 简单离子半径:②>⑧>⑨
B. 简单氢化物的稳定性:⑤>⑧
C. 最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D. ①与⑤可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O ________________
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为__________, 被氧化的N原子的物质的量为__________。
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为_________、_________、_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来我国科学家在青蒿素应用领城取得重大进展,如利用下述反应过程可以制取治疗疟疾的首选药青蒿琥酯。下列有关说法正确的是
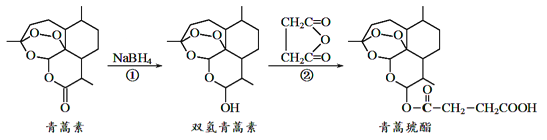
A. 青蒿素分子中所有碳原子在同一平面内
B. 反应①属于还原反应,反应②理论上原子利用率可达100%
C. 双氢青蒿素属于芳香族化合物
D. 青蒿琥酯可以发生水解、酯化以及加聚反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+![]() O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
A. ① B. ④ C. ①②③ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A a>b>c>d B b>c>d>a C d>a>b>c D a>b>d>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com