
科目: 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
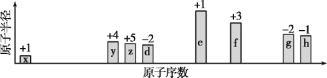
根据判断出的元素回答问题:
(1)h在周期表中的位置是________。
(2)比较d、f离子半径大小(用化学式表示,下同):____>____。比较g、h的最高价氧化物对应水化物的酸性强弱:____>____。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸溶液与氨水反应的离子方程式正确的是
A.OH-+ H+= H2O
B.NH3·H2O+H+= NH4+ + H2O
C.OH-+ HAc = Ac-+ H2O
D.NH3·H2O + HAc =NH4+ + Ac-+ H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是( )
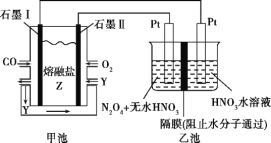
A. 石墨Ⅰ是原电池的负极,发生氧化反应
B. 甲池中的CO32-向石墨Ⅱ极移动
C. 乙池中左端Pt极电极反应式:N2O4-2e-+2HNO3![]() 2N2O5+2H+
2N2O5+2H+
D. 若甲池消耗标准状况下的氧气2.24 L,则乙池中产生氢气0.05 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列化合物中:H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,CaF2,MgCl2请你回答下列问题:
①I2的电子式为_________________;CaF2的电子式为_________________;
②只有极性共价键的共价化合物是________________;
③既有离子键又有非极性键的化合物是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。
【答案】(1)氢(2)第2周期ⅣA族(3)Cl
(4) HClO+H2O+SO2=H2SO4+HCl
HClO+H2O+SO2=H2SO4+HCl
【解析】试题分析:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,据此答题.
解:四种短周期元素A、B、C、D,四种元素之间形成甲、乙、丙三种分子,由信息②,甲分子为V型结构,是地球上最常见的物质之一,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分,故甲为水,乙为正四面体结构,无色无味而易燃,是21世纪的主要能源,乙为甲烷,丙分子有3个不同的原子,至少还有C、H、O中的两种,且有强氧化性,可以用于消毒杀菌,丙应是HClO,再根据信息①原子半径大小:A>B>C>D可得,A为Cl元素、B为C元素、C为O元素、D为H元素,
(1)根据上面的分析可知,甲、乙、丙中含有共同元素是氢元素,
故答案为:氢;
(2)B为碳元素,在周期表中第二周期第IVA族,
故答案为:第二周期第IVA族;
(3)上述元素的原子M层有一个未成对p电子的是氯元素,
故答案为:Cl;
(4)丙为次氯酸,它的电子式为![]() ,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
,次氯酸与SO2水溶液可发生氧化还原反应,生成两种强酸,反应方程式为HClO+H2O+SO2=H2SO4+HCl,
故答案为:![]() ;HClO+H2O+SO2=H2SO4+HCl.
;HClO+H2O+SO2=H2SO4+HCl.
【题型】推断题
【结束】
19
【题目】现有部分前36号元素的性质或原子结构如下表
| 元素编号 | 元素性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X | |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是________________________________________________________。
(2)S元素的化合价是否有正价?__________,原因是__________________________________,最外层电子排布式为________________________。
(3)T元素的原子N能层上电子数为__________,其原子结构示意图为__________。
(4)X的核外电子排布图违背了__________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2![]() 2NH4++SO32-+H2O
2NH4++SO32-+H2O
B. Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-![]() CaCO3↓+ CO32-+2H2O
CaCO3↓+ CO32-+2H2O
C. 磁性氧化铁溶于足量稀硝酸:Fe3O4+8H+![]() Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
D. 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com