
科目: 来源: 题型:
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:

(1)写出由铜和浓硫酸制取SO2的化学方程式_______________________________。
(2)装置A中的现象是__________________________________________________。反应结束后若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在蒸发操作中要用到的主要仪器有_______(填编号)。自然干燥晶体而不烘干晶体的原因是___________________________。
A.酒精灯 B.蒸发皿 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式__________________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明SO2的还原性比I-_________(填“强”或“弱”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质,按酸、碱、盐、非电解质的顺序排列的是
A. 硫酸、胆矾、氯化镁、二氧化碳 B. 硝酸、烧碱、干冰、苏打水
C. 醋酸、消石灰、明矾、铜 D. 氯化氢、苛性钠、NaHCO3、氨气
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如图所示:
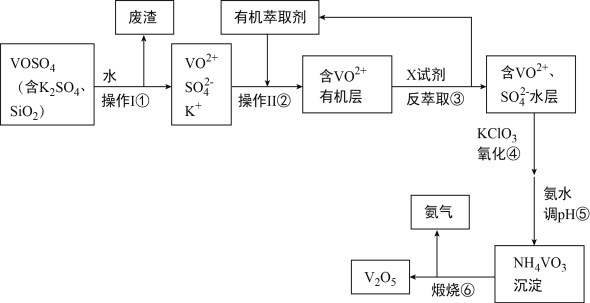
回答下列问题:
(1)步骤①所得废渣与强碱反应得离子方程式_______________________________,操作Ⅱ的名称是_______________________。
(2)步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
2RAn(有机层)+nH2SO4(水层,X试剂为__________(写化学式)。
(3)按要求完成下列方程式。④的离子方程式为__________________,其中氧化剂与氧化产物的物质的量之比为_____________,若有245gKClO3参与反应时,转移的电子数目为__________。加氨水调节pH过程中涉及的离子方程式为:__________________________________。
(4)该工艺流程中可以循环利用的物质有_________________和_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 常温下,物质的量浓度均为0.1 mol·L-1 Na2CO3和 NaHCO3的等体积混合溶液中: 2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32-)
B. △H<0,△S>0的反应都是自发反应,△H>0,△S>0的反应任何条件都是非自发反应
C. 已知:P4(g)+6Cl2(g)=4PCl3(g)△H= akJ·mol-1 P4(g)+10Cl2(g)=4PCl5(g) △H=bkJ·mol-1 P4具有正四面体结构,PCl5中P-Cl键的键能为 ckJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1,由此计算Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D. 在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)=2SO3(g) △H<0,当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平离子方程式(将化学计量数填于空白处)____I-+____IO3—+____H+ =____I2+____H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的化学方程式是:____________________________。
②某学生设计回收四氯化碳的操作为:a.加入适量Na2SO3稀溶液; b.分离出下层液体;c.将碘的四氯化碳溶液置于分液漏斗中; d.将分液漏斗充分振荡后静置。其中分液漏斗使用前须进行的操作是_______,上述操作正确的顺序是:_______(填序号)
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取ag食盐,加适量蒸馏水使其完全溶解;b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;c.以淀粉为指示剂,逐滴加入物质的量浓度为1.0×10-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______________________。
②b中反应所消耗的KI的物质的量是____________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含a的代数式表示)_____mg/kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )

A. Z元素位于周期表的第3周期第VA族
B. X的原子半径比Y小
C. Y元素的气态氢化物的热稳定性比Z的高
D. X、W元素的最高价氧化物对应水化物的酸性:W强于X
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与人类生产生活、社会可持续发展密切相关,下列说法不正确的是
A.利用高纯度硅制造的太阳能电池板可将光能直接转化为电能
B.医院里的血液透析利用了胶体的性质
C.“天宫一号”中使用的碳纤维,是一种新型无机非金属材料
D.二氧化硫是一种有毒物质,不能添加到任何食品中
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作和现象与所得结论一定正确的是
选项 | 操作 | 现象 | 结论或解释 |
A | 向黄色的Fe(NO)3溶液中滴加氢碘酸,再加入一定量CCl4振荡并静置 | 下层溶液变为紫红色 | 氧化性:Fe3+>I2 |
B | 向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 原溶液中一定大量存在SO32- |
C | 向Mg2+和Cu2+共存的溶液中滴加适量 NaOH溶液,过滤、洗涤 | 得到白色沉淀 | 相同温度下,溶度积常数: Ksp[Mg(OH)2]< Ksp [Cu(OH)2] |
D | 一定温度下,向K2Cr2O7溶液中加入少量KOH溶液 | 溶液橙色变浅 | 减小H+浓度, Cr2O72-+H2O |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com