
科目: 来源: 题型:
【题目】下列各组物质相互混合反应后,最终有白色沉淀生成的是
A. 金属钠投入到FeCl3溶液中 B. 明矾溶液和过量NaOH溶液混合
C. 向Na2SiO3溶液中通入足量CO2 D. 氯化钙溶液中通入少量的CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为__________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
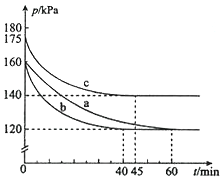
①实验a从反应开始至达到平衡时的反应速率v(AX5)=________(保留两位有效数字)。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为___________ (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:
b____________________、c____________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外小组在实验室用二氧化锰和浓盐酸共热制备氯气,并进行氯气性质的研究。
(1)该小组同学欲用下图所示仪器及试剂制备并收集纯净、干燥的氯气。
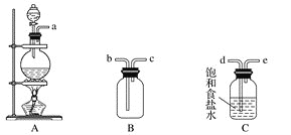
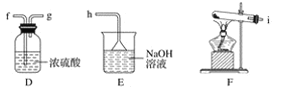
①用不到的仪器是________(填大写字母)
②将各仪器按先后顺序连接起来,应该是:___________(用导管口处的字母表示)。
③浓盐酸与二氧化锰反应的离子方程式_____________
④ C的作用___________,D的作用_______,E中倒置漏斗的作用是_________
(2)该小组同学设计如下所示装置探究氯气的氧化性。
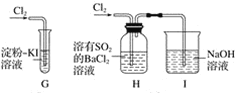
① 通少量Cl2时,G中的现象是_______,原因是_________(用化学方程式表示)
② H中的现象是__________________。
③ 烧杯中NaOH溶液的作用是______________
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯二氧化硅可用来制造光纤。某稻壳灰的成分为
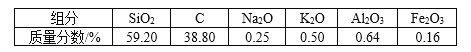
通过如下流程可由稻壳灰制备较纯净的二氧化硅。

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是________。
(2)步骤①中涉及SiO2的离子反应方程式为______________。
(3)滤渣A的成分有________和_________(填化学式)。
(4)滤渣B的成分是________(填化学式)。
(5)过滤所需的玻璃仪器除烧杯和玻璃棒外,还有________。
查看答案和解析>>
科目: 来源: 题型:
【题目】功能高分子P的合成路线如下:

(1)A的分子式是C7H8,其结构简式是________________________。
(2)试剂a是____________________。
(3)反应③的化学方程式:_________________________________________________。
(4)E的分子式是C6H10O2。E中含有的官能团:_________________________。
(5)反应④的反应类型是____________________________。
(6)反应⑤的化学方程式:_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用废铅蓄电池的铅泥(含PbSO4、PbO和Pb等)可制备精细化工产品3PbO·PbSO4·H2O(三盐),主要制备流程如下。

请回答下列问题:
(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为_____________。
2PbSO4+2H2O。若铅蓄电池放电前正、负极质量相等,放电时转移了1 mol电子,则理论上两极质量之差为_____________。
(2)将滤液Ⅰ、滤液Ⅲ合并,经蒸发浓缩、降温结晶、过滤等操作,可得到一种结晶水合物(Mr=322),其化学式为______________________。
(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO。滤液Ⅱ中溶质的主要成分为______(填化学式)。
(4)步骤⑥合成三盐的化学方程式为______________________。
(5)步骤⑦的洗涤操作中,检验沉淀是否洗涤完全的操作方法是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)硫酸厂的酸性废水中砷(As)元素(主要以H3AsO3形式存在)含量极高,为控制砷的排放,某工厂采用化学沉淀法处理含砷废水。请回答以下问题:
①已知砷是氮的同族元素,比氮原子多2个电子层,砷在元素周期表的位置为____________。
②工业上采用硫化法(通常用硫化钠)去除废水中的砷,生成物为难溶性的三硫化二砷,该反应的离子方程式为_____________________。
(2)电镀厂的废水中含有的CN-有剧毒,需要处理加以排放。处理含CN-废水的方法之一是在微生物的作用下,CN-被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为_____________。
(3)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子):
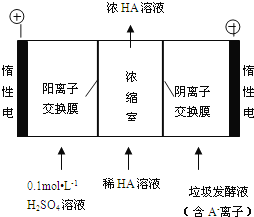
①阳极的电极反应式为________________________。
②简述浓缩室中得到浓乳酸的原理:________________________。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g/L 乳酸溶液通电一段时间后,浓度上升为145 g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为________L(提示:乳酸的摩尔质量为90 g/mol)。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于微粒半径大小的下列叙述中不正确的是( )
A.随原子序数的递增,同周期元素的原子半径逐渐减小(稀有气体除外)
B.随电子层数的递增,同主族元素的原子半径逐渐增大
C.电子层结构相同的离子,核电荷数越大,半径越大
D.同主族带相同电荷的离子,电子层数越多,半径越大
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸.请根据以上信息回答下列问题.
(1)C元素在元素周期表中的位置是________________
(2)画出B元素的离子结构示意图______________
(3)与E的氢化物分子所含电子总数相等的分子是_____(举一例,填化学式,下同)、离子是_________
(4)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为_________
(5)写出A元素与B元素形成化合物的化学式________
(6)下列可以判断C和D非金属性强弱的是_______
a.单质的熔点C比D低 b.单质与氢气反应C比D剧烈
c.气态氢化物稳定性C比D稳定 d.单质的密度C比D小
查看答案和解析>>
科目: 来源: 题型:
【题目】向一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是
A.加入的碱过量
B.反应后溶液中c(A-)=c(M+)
C.混合前酸与碱中溶质的物质的量相等
D.生成的盐发生水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com