
科目: 来源: 题型:
【题目】碳酸氢钠广泛地应用于生产、实验和日常生活中。某课外小组同学通过查阅资料对碳酸氢钠的性质和制法进行了系列实验,请你参与探究。
(1)向NaHCO3溶液滴加MnCl2溶液生成沉淀MnCO3,离子方程式为______。
(2)向NaHCO3溶液加入少量的镁粉,观察到有气体和白色沉淀生成,则该气体一定是______(填化学式),白色沉淀可能是:①MgCO3;②Mg(OH)2;③Mg2(OH)2CO3。欲证明白色沉淀为②,简单的实验方法为______(操作、现象和结论)。
(3)电解Na2CO3溶液制NaHCO3的原理如图—1所示.
①电解初期,电解池中总反应方程式为______。
②若电解过程中透过交换膜的Na+为 0.4 mol,则阳极收集到 O2_____L(标况)。
③电解后期溶液中的含碳微粒逐渐减少,此阶段阳极反应式为______。
(4) “侯氏制碱法”的原理是: NaCl+NH3+ CO2+H2O= NaHCO3+NH4Cl,模拟该制法的部分装置如图—2所示.
① 正确的操作是______(填序号)。
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b通入NH3,然后a通入CO2,c中放碱石灰
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
② 水槽中的冷水起降温作用,这样有利于______。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氧化铝和氢氧化铝的叙述错误的是( )
A. Al(OH)3受热能分解
B. Al2O3既能溶于强酸溶液又能溶于强碱溶液
C. Al(OH)3胶体能吸附水中的悬浮物
D. Al(OH)3与过量的浓氨水反应生成NH4[Al(OH)4]
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取SO2并验证SO2的某些性质的装置,试回答

试回答:
(1)②中的实验现象为______________。
(2)④中的实验现象为______________,此实验说明SO2有____________性.
(3)⑤中的实验现象为____________,此实验说明SO2有________性.
(4)⑥的作用是___________,反应方程式是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
![]() 杂化轨道是由同一个原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
杂化轨道是由同一个原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
![]() 同一周期从左到右,元素的第一电离能、电负性都是越来越大
同一周期从左到右,元素的第一电离能、电负性都是越来越大
![]() 分子中键能越大,表示分子拥有的能量越高
分子中键能越大,表示分子拥有的能量越高
![]() 所有的配合物都存在配位键
所有的配合物都存在配位键
![]() 所有含极性键的分子都是极性分子
所有含极性键的分子都是极性分子
![]() 熔融状态下能导电的化合物一定是离子化合物
熔融状态下能导电的化合物一定是离子化合物
![]() 所有的原子晶体都不导电
所有的原子晶体都不导电
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求完成下列问题
(1)单质铝和氢氧化钠溶液反应的化学方程式_________________,本反应中的氧化剂是_______。
(2)实验室用二氧化锰和浓盐酸制取氯气的离子方程式_____________________。本反应中的氧化剂和还原剂的物质的量比为_____________________。
(3)二氧化硫和氯气按等物质的量通入足量水中的化学方程式_______________,本反应中若有1mol氧化剂参加反应则转移电子数目为_____________________。
(4)浓硝酸一般显黄色,用方程式解释原因:______________,可向浓硝酸中通入_______消除黄色。
查看答案和解析>>
科目: 来源: 题型:
【题目】粉煤灰(主要含有 SiO2、Fe2O3、Al2O3 等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有 很大的价值。
Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。
①写出硫酸溶液与 Fe2O3 反应的离子方程式_____。
②初步分离得到的滤渣主要成分是_____。
(2)向(1)分离所得的滤液中加入还原剂使 Fe3+转化为 Fe2+,结合下表分析其原因____。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验。
①氨水使滤液中铝离子沉淀的离子方程式为_____。
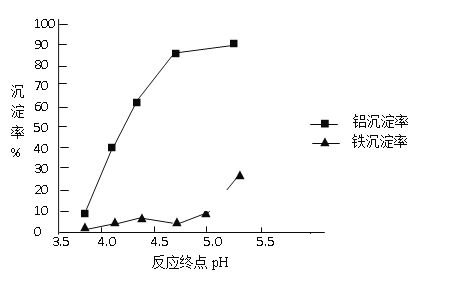
②反应终点的pH对铝和铁分离效果的影响如下图。根据实验结果,为达到好的分离效果,反应过程中控制pH的 范围是______________,选择该范围的理由是___________________。
Ⅱ.NH4HSO4和H2SO4按物质的量比1∶1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵 [NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3。 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g。②280℃时分解。
(1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是_____。
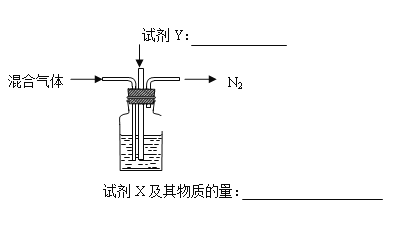
(2)煅烧 NH4Al(SO4)2 同时得到混合气体(NH3、N2、SO2、SO3、H2O)。若 16 mol 混合气体按如下装置被完全吸收制得浸取液,请将下图中试剂(化学式)及其物质的量补充完整。____________,___________
4NH4Al(SO4)2 ![]() 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑
查看答案和解析>>
科目: 来源: 题型:
【题目】关于生物体内元素的叙述,正确的是( )

A. 各种元素在细胞与非生物界的含量差异不大
B. 细胞内含量最多的元素是C,因此C是生命的核心元素
C. 细胞内含有Fe、Cu、Mn、Zn、B、Mo等作用不重要的微量元素
D. 烘干的植物细胞中含量最多的元素是C
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。活泼金属硫化物与酸反应产生H2S气体。
Ⅰ、制备氢化锂:选择下图中的装置制备氢化锂(有些装置可重复使用):
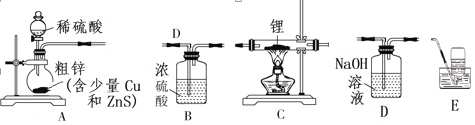
(1)装置的连接顺序(从左至右)为A→___________________________________。
(2)检查好装置的气密性,打开装置A中分液漏斗的活塞后,点燃酒精灯前需进行的实验操作是________。
Ⅱ、制备氢化铝锂
1947年,Schlesinger、Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)写出氢化锂与无水三氯化铝反应的化学方程式_________________________。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度
(4)按下图连接好装置后,检查装置气密性的操作是:_____________________。装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是__________________。
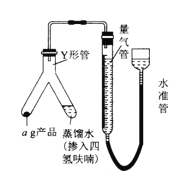
(5)在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为_________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com