
科目: 来源: 题型:
【题目】H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1ml,滴定过程中发生的一个反应为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为_________________。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用_________。
a.普通漏斗和滤纸 b.布氏漏斗和滤纸 c.不需滤纸的微孔玻璃漏斗
(3)标定KMnO4标准液时需要控制温度为75~85℃,温度过低反应较慢,温度过高可能会因_____而导致KMnO4标准液的标定浓度偏高,在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是__________________。
(4)KMnO4标准液滴定H2O2的离子方程式为___________________;当滴定到______________可以认为已达到滴定终点。
(5)该医用消毒剂中H2O2的物质的量浓度为_______________mol·L-1。
(6)②中若用盐酸代替H2SO4,测定结果将___________(填“偏高”“ 偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物J的分子式为C10H12O3,是一种重要的化工原料,可用作溶剂、催化剂、塑料助剂以及合成医药、农药等.目前,我国有关J的用途是作为农药胺硫磷、甲基异柳磷的中间体.如图是这种有机物的合成方案: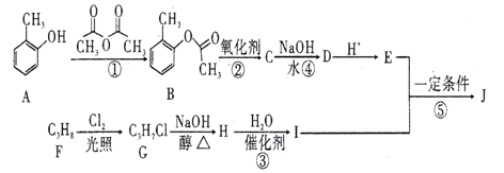
已知:有机物I中含有两个化学环境相同的甲基
请回答下列问题:
(1)写出下列反应的反应类型:①_________,②_________
(2)写出反应③的化学方程式:_________
(3)J的结构简式为:_________
(4)反应①所起的作用是________________
(5)F的核磁共振氢谱共有__________个吸收峰,其面积之比为_______
(6)下列有关E的性质说法,正确的是___
a.1mol该有机物与足量碳酸氢钠反应产生2mol的CO2
b.能使FeCl3溶液显色
c.该有机物不能形成高分子化合物
(7)满足下列条件且与有机物J互为同分异构体的有机物共有___种,任写出其中一种的结构简式:__________
A.苯环上仅有两个对位取代基 B.能发生水解反应 C.遇浓溴水能发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】中学化学中下列各物质间不能实现 (“→”表示一步完成)转化的是
(“→”表示一步完成)转化的是
选项 | A | B | C | D |
a | CH3CH2OH | CH2=CH2 | Cl2 | C |
b | CH3CHO | CH3CH2Br | HClO | CO |
c | CH3COOH | CH3CH2OH | HCl | CO2 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】核安全与放射性污染防治已引起世界各国的广泛重视。在爆炸的核电站周围含有放射性物质碘131和铯137。碘131一旦被人体吸入,可能会引发甲状腺疾病。
(1)Cs(铯)的价电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ·mol-1) | 520 | 496 | 419 |
上述三种元素X、Y、Z的元素符号分别为________,基态Z原子的核外电子排布式为________,X形成的单质晶体中含有的化学键类型是________。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为________、________,BeF2分子的立体构型是________,H2O分子的立体构型是________。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BCl3分子中B—Cl键的键角为________。
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有________个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻________个I-。

甲 乙
(5)KI晶体的密度为ρ g·cm-3,K和I的摩尔质量分别为MK g·mol-1和MIg·mol-1,原子半径分别为rKpm和rIpm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)反应①达平衡后采取下列措施,能提高CH3OH产率的有__________。
A.加入H2 B.升高温度 C.增大压强 D.使用催化剂
(3)在一定温度下,将4mol CO和4mol H2混合置于2L的密闭容器中发生反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
(4)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
A. 氢气和二氧化碳的浓度之比为3∶1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(5)二甲醚燃料电池的工作原理如图所示:
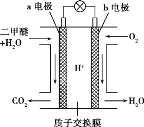
该电池负极的电极反应式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质结构和化学用语的说法正确的是( )
A. 39 g Na2O2晶体中所含阴、阳离子总数为2NA
B. 1个氮气分子中存在3对共用电子对
C. NaOH和Na2O中所含的化学键类型完全相同
D. AlCl3和MgF2中都含有共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物的结构简式如图: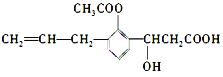 。则此有机物可发生的反应类型有 ( )
。则此有机物可发生的反应类型有 ( )
①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦中和 ⑧加聚
A. ①②③⑤⑥ B. ②③④⑤⑥⑧ C. ②③④⑤⑥⑦ D. ①②③④⑤⑥⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】关于图中装置说法正确的是

A. 装置中电流移动的途径:正极→Fe→M溶液→石墨→正极
B. 若M为滴加酚酞的NaCl溶液,通电一段时间后,铁电极附近溶液显红色
C. 若M为CuSO4溶液,可以实现石墨上镀铜
D. 若将电源反接,M为NaCl溶液,可以用于制备Fe(OH)2并可以使其较长时间保持白色
查看答案和解析>>
科目: 来源: 题型:
【题目】锂空气电池放电时的工作原理如图所示。下列叙述正确的是( )

A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2O===4LiOH
C. B电极反应式为O2+4H++4e-===2H2O
D. 电解液a可以为氯化锂溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列我国合成的材料中,主要成分由同周期两种元素组成的是
A.可实现高温超导的钙钛矿(CaTiO3)薄膜
B.制造大口径高精度非球面反射镜的碳化硅材料
C.大面积单品六方氮化硼半导体材料
D.可淡化海水的石墨烯纳米网
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com