
科目: 来源: 题型:
【题目】下表列出了①~⑤五种元素在周期表中的位置:
ⅠA | O | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ||||||
请回答下列问题:
(1)写出以上五种元素对应的元素符号_______、_______、_______、_______、_______;
(2)②和③元素所形成的气态氢化物的稳定性由强到弱的顺序是(________)
A.前者大 B.后者大 C.相等 D.无法比较
(3)②元素的最高价氧化物的水化物呈(填“酸”、“碱”、“中”)_______性;
(4)②③两种元素的原子半径由大到小的顺序是(用元素符号表示)_______;
A.前者大 B.后者大 C.相等 D.无法比较
(5)①与⑤两种元素形成的化合物的化学式是_______;
(6)②与④两种元素的最高价氧化物的水化物在溶液中相互反应的化学方程式是____;
(7)写出①的氧化物含有的化学键类型_______,写出⑤的原子结构示意图_______;
(8)写出元素③处于第_______周期,第_______族;
(9)写出实验室制取⑤的单质的化学反应方程式_______;实验结束时,尾气处理应选择的试剂是_______溶液(化学式或名称);
(10)周期表中,同一主族从上往下原子半径_______,_______递增;周期表中,同一周期从左向右原子半径_______,_______递增。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于铜锌原电池(如图所示)的说法正确的是
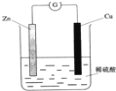
A. Zn是负极,发生还原反应 B. Cu是负极,发生氧化反应
C. 铜片上有气体逸出 D. 电子由铜片通过导线流向锌片
查看答案和解析>>
科目: 来源: 题型:
【题目】有一无色溶液,仅含有![]() 中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量
中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量![]() 固体,产生无色无味的气体和白色沉淀,再加入足量的
固体,产生无色无味的气体和白色沉淀,再加入足量的![]() 溶液后白色沉淀部分溶解;②另取部分溶液,加入
溶液后白色沉淀部分溶解;②另取部分溶液,加入![]() 酸化的
酸化的![]() 溶液,无沉淀产生。下列推断正确的是
溶液,无沉淀产生。下列推断正确的是
A. 肯定有![]() ,可能有
,可能有![]()
B. 肯定有![]() ,肯定没有
,肯定没有![]()
C. 肯定有![]() ,可能有
,可能有![]()
D. 肯定有![]() ,可能有
,可能有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器中发生反应A(g)+3B(g)![]() 2C(g),30s内C的物质的量增加了0.6mol,下列关于速率表示正确的是( )
2C(g),30s内C的物质的量增加了0.6mol,下列关于速率表示正确的是( )
A. v(A)=0.005mol·L-1·s-1B. v(C)=0.002 mol·L-1·s-1
C. v(B)=0.003 mol·L-1·s-1D. v(A)=0.001mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲、乙两个装置的烧杯中分别盛有足量的CuCl2溶液。
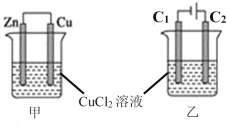
(1)甲装置中,Zn电极发生______反应(填“氧化”或“还原”),溶液中Cl-向_____极(填“Zn”或“Cu”)移动,Zn电极反应式为_______,若反应过程中有0.1mol电子发生转移,则Cu极质量增加__________。
(2)乙装置中,石墨电极C1是_______极,现象是______,C2极电极反应式为_______,若反应过程中阴极析出12.8g的Cu,则阳极产生的气体在标准状况下的体积为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组称取纯净的Na2SO3 ·7H20 a克,隔绝空气加强热至恒重,经过分析与计算,得到的固体质量与全部转化为亚硫酸钠固体的计算值一致,但固体在水中溶解后测的pH值比理论计算值(相同浓度Na2SO3溶液的pH)大很多。下列说法不正确的是
A. 连续两次称量强热前后固体的质量,如质量差小于0.1g,即可判断固体已经恒重
B. 产生上述矛盾的可能解释:4Na2SO3 ![]() 3Na2SO4 + Na2S
3Na2SO4 + Na2S
C. 固体产物中加入稀盐酸可能有淡黄色沉淀产生
D. 加入BaCl2溶液,出现白色沉淀,则能确定产物中有Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中,FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是
A. 装置F、I中的试剂依次为水,硫酸亚铁溶液
B. 装置J收集的气体中不含NO
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可以由N2和H2合成NH3,已知该反应为放热反应。
(1)写出该反应的化学方程式______________。已知:1molN2的共价键断裂吸收的能量为Q1kJ;1molH2的化学键断裂吸收的能量为Q2kJ;形成1molNH3中的化学键释放的能量为Q3kJ。则Q1+3Q2_____2Q3(填“>”、“<”或“=”)。
(2)写出加快合成氨反应速率的措施_______________。
(3)工业上也可通过电解的方法由N2制取NH3:2N2 +6H2O![]() 4NH3 +3O2,若制得8.96L(标准状况下)NH3,转移电子_____mol。
4NH3 +3O2,若制得8.96L(标准状况下)NH3,转移电子_____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com