
科目: 来源: 题型:
【题目】汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH = a kJ·mol-1。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
2CO2(g)+N2(g) ΔH = a kJ·mol-1。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
回答下列问题:
(1)在上述条件下该反应能自发进行,则正反应必然是_______反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率υ(N2)=___________,t1℃时该反应的平衡常数K=________。
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是_______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol-1
则处理汽车尾气反应中的a=__________。
(5)用活性炭还原法也可以处理氮氧化物,有关反应为:C(s)+2NO(g) ![]() CO2(g)+N2(g) ΔH4。向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
CO2(g)+N2(g) ΔH4。向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
NO | N2 | CO2 | |
起始浓度/mol·L-1 | 0.10 | 0 | 0 |
平衡浓度/mol·L-1 | 0.04 | 0.03 | 0.03 |
平衡后升高温度,再次达到平衡测得容器中NO、N2、CO2的浓度之比为5:3:3,则ΔH4_______0(填“ >”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的![]() (如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关
(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关![]() 的说法正确的是
的说法正确的是

A. 分子中N、O间形成的共价键是非极性键
B. 分子中四个氮原子共平面
C. 该物质既有氧化性又有还原性
D. 15.2g该物资含有6.02×![]() 个原子
个原子
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,在一恒容密闭容器中,能表示反应X(g)+Y(g) ![]() 2Z(g)一定达到平衡状态的是( )
2Z(g)一定达到平衡状态的是( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Y,同时生成2n mol Z
A.①② B.②④ C.③④ D.①④
查看答案和解析>>
科目: 来源: 题型:
【题目】X+的核外电子数分别为2、8、8,则X元素在周期表中的位置是( )
A. 第三周期第0族 B. 第四周期第ⅠA族
C. 第三周期第ⅠA族 D. 第三周期第ⅦA族
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D 均为气体,对于A+3B![]() 2C +D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
2C +D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
A. v(A)=0.4mol/(Ls)B. v(B)=0.8mol/(Ls)
C. v(C)=0.6mol/(Ls)D. v(D)=0.5mol/(Ls)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了A~X元素在周期表中的位置,填写下列空白:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
一 | A | |||||||
二 | L | M | Q | |||||
三 | D | G | J | R | X | |||
四 | E | T |
(1)这些元素中,化学性质最不活泼的是:______(用具体元素符号或化学式等化学用语填空,下同)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物是________,该化合物与性质表现为两性氢氧化物的物质反应的离子方程式为__________________________________。
(3)G元素与T元素形成的化合物属于_______(填“共价”或“离子”)化合物。
(4)D、E、G三种元素按原子半径由大到小的顺序排列__________________。
(5)A元素的单质分别与M元素的单质、R元素的单质反应生成甲、乙,甲、乙常温下均为气态,且两者相遇时可化合成丙。化合物丙的电子式为_____________。
(6)R元素和T元素两者核电荷数之差是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.实验室常用MnO2与浓盐酸反应制备Cl2(装置如图所示)。

(1)制备实验开始时,先检査装置气密性,接下来的操作依次是:_______(填序号)。
①往烧瓶中加入MnO2粉末;②加热;③往烧瓶中加入浓盐酸
(2)写出圆底烧瓶中发生反应的离子方程式_______________________。
(3)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法_______(填字母序号)。
a.将Cl-转化为AgCl沉淀,过滤,洗涤,干燥,称量沉淀的质量
b.与足量NaHCO3固体反应,将反应后气体直接用碱石灰吸收,测定生成气体的质量
c.与足量锌反应,测量生成气体标准状况下的体积
II.为测定某亚硫酸钠样品纯度,研究小组利用如下装置(装置图中夹持仪器已省略)进行实验。
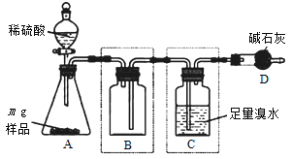
反应完全后,向C中溶液加入过量BaCl2溶液,过滤、操作①、干燥、称量,利用所得数据计算样品纯度。请回答:
(4)操作①的名称是____________。
(5)装置B的作用是______________________。
(6)最终所得固体质量为b g,则该样品中亚硫酸钠的质量分数为____________(用含字母m、b的代数式表示)。
(7)上述实验测得的样品纯度比实际偏低,为提高测定结果的准确度,可采取的改进措施是________________________________________(写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com