
科目: 来源: 题型:
【题目】X、Y、Z、Q、R是原子序数依次增大的短周期主族元素。已知:气体YX3能使润湿的红色石蕊试纸变蓝,Z和X在同一主族,Q原子的最外层电子数是其周期序数的2倍。回答下列问题:
(1)Q在元素周期表中的位置为___,YX3的电子式为____(用元素符号表示)。
(2)X、Y、Z原子的半径从大到小的顺序是______(用元素符号表示)。
(3)X2Q与Y的最高价氧化物的水化物的稀溶液反应会生成Q单质,试写出该反应的化学方程式___。
(4)能证明R的非金属性比Q强的实验事实是____(填字母序号)。
a.R2与H2化合比Q与H2化合容易,且HR的稳定性比H2Q强
b.H2Q的水溶液中通少量的R2气体可置换出单质Q
c.HR的水溶液酸性比H2Q的水溶液酸性强
(5)气体YX3在水中的溶解性特别大的原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸(HNO2)是一种弱酸,且不稳定,易分解生成NO、NO2和H2O。它能被常见的强氧化剂氧化,在酸性溶液中它又是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)常温下,NaNO2溶液的pH_______(填“>”、“<”或“=”)7,其原因是__________(用离子方程式表示)
(2)NaNO2能和HI发生反应:2 NaNO2+4HI=2NO+I2+2NaI+2H2O,若有0.5mol的还原剂被氧化,则消耗氧化剂________mol,该过程中转移的电子数为____________。
(3)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(4)某工厂废液中含2%的NaNO2,直接排放会造成污染,下列试剂中:①NaCl ②NH4Cl③H2O2 ④ 浓硫酸,能使其转化为不引起二次污染的N2的是________(填序号),反应的离子方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲烷(CH4)和白磷(P4)分子的空间结构示意图,请把你认为是化学键的虚线改为实线,把碳原子涂成实心小圆点(在图上改即可__________)。甲烷分子是________(填“左”、“右”)图。从图中看出,每个甲烷分子中有________对共用电子,而白磷分子中形成______个共价键,键角为________。甲烷是由________键(填“极性”或“非极性”,下同)形成的________分子,白磷是由________键形成的________分子。
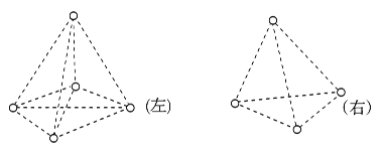
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
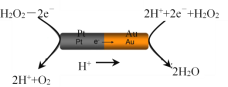
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组同学对有关物质的分类进行讨论辨析:①Na2O2、MgO都属于碱性氧化物; ②在常温下,NaHCO3溶液、NaHSO4溶液的pH值皆小于7;③司母戊鼎、氯水皆属于混合物;④由非金属元素组成的化合物可能属于盐。上述说法中正确的是( )
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目: 来源: 题型:
【题目】氯乙烯是合成聚氯乙烯(PVC)的单体。乙烯氧氯化法是生产氯乙烯的主要方法,分三步进行(如图所示):

(1)下列关于乙烯、氯乙烯和聚氯乙烯的说法中,正确的是________(填字母)。
A.都能在氧气中燃烧 B.都能发生加成反应使溴水褪色
C.都能使高锰酸钾酸性溶液褪色 D.氯乙烯分子中所有原子处于同一平面
(2)从环境保护的角度分析,氧氯化法的优点是_______________________________。
(3)某学生设计了下列反应:
![]()
请写出③的化学方程式________________________________________________。
(4)已知二氯乙烷与NaOH溶液共热可生成乙二醇(HO—CH2CH2—OH),请写出乙二醇与乙酸发生完全酯化反应的化学方程式________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)甲醇是重要的化工原料,CO和CO2均可用于合成甲醇。用CO2来生产甲醇的反应方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
(1)已知:
2CO(g)+O2(g)=2CO2(g) △H2
2H2(g)+O2(g)=2H2O(g) △H3
则CO(g)+ 2H2(g)=CH3OH(g) △H4=_______
(2)由CO合成甲醇时,CO的平衡转化率与温度和压强的关系如图所示。P点和Q点的平衡常数的大小KP____ KQ (填“大于”、“小于”或“等于”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________________。

(3)一定温度下,向2 L密闭容器中加入1 mol CH3OH(g),发生反应CH3OH(g) =CO(g)+ 2H2(g),CO的体积分数随时间的变化如图所示。

①反应达到平衡状态的标志是___________。
A.气体的密度不变
B.气体的压强保持不变
C.υ正(CH3OH)=2υ正(H2)
D.υ正(H2)=2υ逆(CO)
②该温度下,CO(g)+ 2H2(g)=CH3OH(g)的平衡常数K=_________。
③若在t1时刻再加入1mol CH3OH(g),在t2 时刻重新达到平衡,请在图上画出CO的体积分数随时间变化的曲线(不要求计算具体数值,画出变化的趋势和范围即可)_______。
(4)以CH3OH为燃料(以KOH溶液作电解质溶液)可制成CH3OH燃料电池。负极的电极反应式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com