
科目: 来源: 题型:
【题目】下列离子方程式中正确的是
A. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C. NaHSO4溶液与Ba(OH)2溶液混合后呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D. 二氧化锰和浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:

已知:RX![]() ROH;RCHO+CH3COOR′
ROH;RCHO+CH3COOR′![]() RCH=CHCOOR′
RCH=CHCOOR′
请回答:
(1)B+D→F的化学方程式_______________________________________。
(2)X的结构简式_____。
(3)对于化合物X,下列说法正确的是____。
A.不能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(4)下列化合物中属于F的同分异构体的是______(双选)
A.![]() B.
B.![]()
C.CH2CHCHCHCHCHCHCHCOOH D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A里一种重要的原料,其结构简式为![]() ,可由化合物甲生成。 其转化关系及相应反应如下:
,可由化合物甲生成。 其转化关系及相应反应如下:
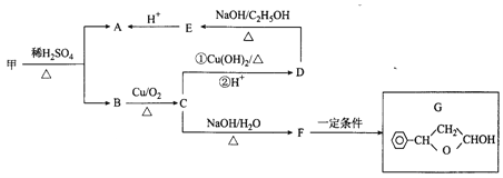
已知:①甲的分子式为C18H17ClO2;
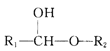
②R1-CHO+R2-OH![]()
回答下列问题:
(1)A的化学名称为________;A分子中最多有_____个碳原子处于同一平面上。
(2)D→E的反应类型为____________;G中含氧官能团名称为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列装置不能达到有关实验目的是( )

A. 用甲图装置证明ρ(煤油)< ρ(钠)< ρ(水)
B. 用乙图装置可以吸收氨气防止倒吸
C. 用丙图装置制取金属锰
D. 用丁装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目: 来源: 题型:
【题目】19.2g 铜和适量的浓硝酸反应,铜全部作用后,收集到 NO、NO2 气体共 11.2L(标准状况),反应消耗的硝酸是_____;气体体积分别为_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】我国清代《本草纲目拾遗》中记载药物“鼻冲水”,写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅。……。虚弱者忌之。宜外用,勿服。……。”这里的“鼻冲水”是指( )
A.醋B.硝酸C.食盐水D.氨水
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示:
C(g)+D(g)过程中的能量变化如图所示:

完成下列填空:
(1)该反应是__________反应(选填“吸热”、“放热”),该反应化学平衡常数表达式为K=____。
(2)在恒温恒容条件下,能判断该反应达到平衡状态的依据是____________。(用文字表示)
(3)若在体系中加入合适的催化剂,则该反应的化学反速率_________,反应的热效应_____(均选填“增大”、“减小”或“不变”)。
(4)达到平衡时,改变一个条件,化学平衡常数不变,A的转化率增大,则该条件是_______。
(5)FeCl3固体溶于蒸馏水常会出见浑浊,得不到澄清的氧化铁溶液。其原因是_________,如果要得到澄清的氯化铁溶液,可采取的措施是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
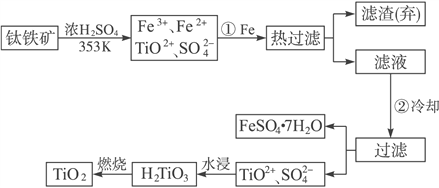
(1)Ti的原子序数为22,Ti位于元素周期表中第_________周期,第________族。
(2)步骤①加Fe的目的是:____________________;步骤②冷却的目的是:____________。
(3)上述制备TiO2的过程中,可以利用的副产物是______________________;考虑成本和废物综合利用因素,废液中应加入________________________ 处理。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是_________________。
(2)A单质的电子式_________________。
(3)D的简单阳离子的离子结构示意图_________________。
(4)A、B、C、D、E五种元素的原子半径由大到小的顺序是(用元素符号填写)_________。
(5)用电子式表示C2B2的形成过程___________________________________。
(6)写出E的单质与C元素的最高价氧化物对应的水化物反应的离子方程式:____;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com