
科目: 来源: 题型:
【题目】对三联苯是一种有机合成中间体,工业上合成对三联苯的化学方程式为:![]() +2H2↑。下列说法正确的是( )
+2H2↑。下列说法正确的是( )
A. 三联苯不是苯的同系物 B. 对三联苯分子中至少有14个碳原子共平面
C. 对三联苯的一氯取代物有3种 D. 对三联苯的分子式为C18Hl8
查看答案和解析>>
科目: 来源: 题型:
【题目】为了验证Na2CO3固体中是否含有NaHCO3,下列实验事实及判断中,正确的是 ( )
A.溶于水后加石灰水,看有无沉淀B.加稀盐酸观察是否有气体产生
C.加热后称重,看质量是否变化D.在无色火焰上灼烧,观察火焰是否呈黄色
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列方程式(注明反应条件),每个方程式2分,共10分
(1)乙醇催化氧化反应:_____________________________________________;
(2)实验室制乙炔的化学反应方程式: _____________________________________________;
(3)苯酚钠溶液通入少量的二氧化碳气体的化学反应方程式: __________________________;
(4)溴乙烷与氢氧化钠水溶液的化学反应方程式: ______________________________;
(5)苯甲醛水溶液与新制的氢氧化铜悬浊液化学反应的方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列转化的化学方程式,注明反应类型。
(1)甲苯→TNT ___________________
(2)苯乙烯→聚苯乙烯__________________
(3)1,3—丁二烯与溴1,4—加成__________________
(4)2-甲基-2-溴丙烷和氢氧化钾乙醇溶液共热___________________
(5)苯甲醇在铜催化下和氧气反应__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤] 是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是
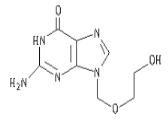
①分子中最多有12个原子在同一平面内; ②属于芳香族化合物; ③是一种易溶于水的醇; ④可以被催化氧化;⑤不能使溴水褪色; ⑥可以燃烧; ⑦ 1 mol阿昔洛韦在催化剂作用下, 最多可与5molH2发生加成反应; ⑧分子式是C8H11N5O3
A. ①②③④⑥⑧
B. ②④⑤⑥
C. ③④⑤⑥⑧
D. ④⑥⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A.硫酸、Na2CO310H2O、Ca(OH)2
B.水、空气、纯碱
C.氧化铁、胆矾、生石灰
D.硝酸、食盐水、烧碱
查看答案和解析>>
科目: 来源: 题型:
【题目】废气中的含氮氧化物是主要的大气污染物,因此脱出废气中的含氮氧化物对于保护大气环境具有重要的意义。
(1)汽车的大量使用是城市大气中含氮氧化物的主要来源。
①汽车燃油中一般不含有氮元素,汽车尾气中的NO是如何产生的?___________(用化学方程式表示)。
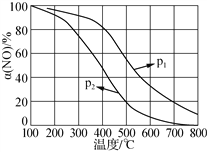
②NO易被O2氧化为NO2。其他条件不变时,NO的氧化率[α(NO)%]与温度、压强的关系如图所示。则p1________p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是_____。
(2)利用氨气脱除NO是大气污染防治研究的热点,过程中涉及的反应为:
主反应:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
②4NH3(g)+4O2(g)![]() 2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
③4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
回答下列问题:
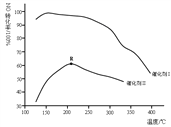
主反应的ΔH为____________________;保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示,选用催化剂I的优势有_________________(写出一点即可);R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由__________________。
(3)碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是__________。
(4)常温下,在通入O2的条件下用0.1mol/L的NaOH溶液吸收NO,产物为NaNO3 和NaNO2。已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数Ka=5.1×10-4),则:
①![]() =________mol/L
=________mol/L
②反应后溶液中NO3-的浓度约为___________mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀______________。(Ksp(AgNO2)=2×10-8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com