
科目: 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应: 2SO2(g)+O2(g)![]() 2SO3(g)。当SO2、O2、 SO3的浓度不再变化时,下列说法正确的是
2SO3(g)。当SO2、O2、 SO3的浓度不再变化时,下列说法正确的是
A. SO2和O2全部转化为SO3
B. 正、逆反应速率相等且等于零
C. 该反应已达化学平衡状态
D. SO2、 O2、SO3的浓度一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】对于下图所示实验,下列实验现象预测或操作正确的是
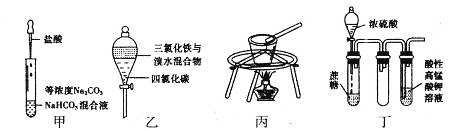
A. 实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:用瓷坩埚融化NaOH
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应:2A(g)+ B(g)![]() 2C(g),分别测定反应在不同温度下达到平衡时B 的转化率,绘制了如图所示的曲线,图中a、b、c三点分别表示不同时刻的状态。下列分析正确的是( )
2C(g),分别测定反应在不同温度下达到平衡时B 的转化率,绘制了如图所示的曲线,图中a、b、c三点分别表示不同时刻的状态。下列分析正确的是( )

A. 该反应的△H<0
B. b点时混合气体的平均摩尔质量不再变化
C. 增大压强,可使a点达到T1温度下平衡状态
D. c点表示的状态:v (正)> v (逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨的能量示意图如下:
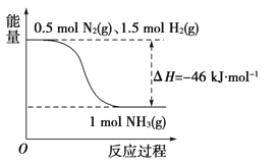
(1)已知分别破坏1 mol N![]() N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N-H键需要吸收的能量为________ kJ。
N键、1 mol H-H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol N-H键需要吸收的能量为________ kJ。
(2)N2H4可视为NH3分子中的H被—NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g)ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:

已知:
①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)请写出FeWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式:______________________________________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子为SiO32―、HAsO32―、HAsO42―等,则“净化”过程中,加入H2O2时发生反应的离子方程式为_________,滤渣Ⅱ的主要成分是______________。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①T1_____T2(填“>”或“<”)T1时Ksp(CaWO4)=______________。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将铜片在空气中灼烧变黑,趁热分别伸入①乙醇、②乙醛、③乙酸、④石灰水中,铜片质量发生变化的叙述正确的是( )
A. ①减小、②不变、③增加、④不变
B. ①不变、②增加、③减小、④增加
C. ①增加、②减小、③不变、④减小
D. ①不变、②减小、③增加、④减小
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
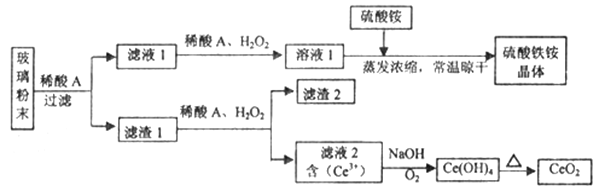
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)滤液1中加入H2O2溶液的目的是____________________________________________________。
(2)设计实验证明滤液1中含有Fe2+__________________________________________________________。
(3)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________________。
(4)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(5)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com