
科目: 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )

A. 反应开始到10 s,用Z表示反应速率为0.158 mol·L-1·s-1
B. 反应开始到10 s时,Y的转化率为79.0%
C. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
D. 反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行
![]() 。有关该电池的说法正确的是
。有关该电池的说法正确的是
A. 放电时负极反应:Cd—2e-+2OH-= Cd(OH)2
B. 充电过程是化学能转化为电能的过程
C. 放电时正极附近溶液的碱性不变
D. 放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+F2(g)![]() 2HF(g)+270kJ,下列说法正确的是( )
2HF(g)+270kJ,下列说法正确的是( )
A. 2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B. 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C. 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D. 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍.该混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g,该混合气体可能是( )
A. 乙烷和乙烯 B. 乙烷和乙烯 C. 甲烷和乙烯 D. 甲烷和丙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH1=484 kJ/mol
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
CH3OH(g)+H2O(g) ΔH2=50 kJ/mol
则2CH3OH(g)+3O2(g)= 2CO2(g)+4H2O(g) ΔH,ΔH=_____________。
(2)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若反应开始到10s时间段内,v(H2)=_____________,既能提高反应速率,又能提高H2转化率的方法是________________________。
②若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
(3)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。
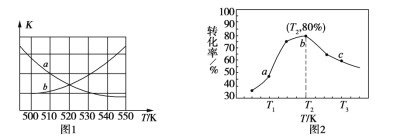
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一切植物中均含有天然有机高分子化合物A,它是构成植物细胞壁的基础物质之一,一般不溶于水,也不溶于有机溶剂。有机物A~F之间的转化如图所示(图中部分产物已略去,且B生成C的同时还有![]() 生成):
生成):
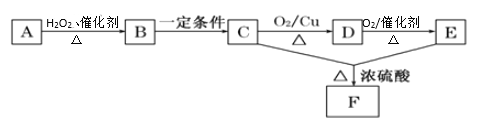
(1)由A生成B的化学方程式为______________。
(2)B、C中均含有的官能团的电子式为_______________。
(3)从A转化为F的过程中发生反应的类型有(______)
A.氧化反应 B.酯化反应 C.加成反应 D.水解反应
(4)写出C→D发生反应的化学方程式:____________。
(5)F有多种同分异构体,请写出其中与它具有相同官能团的所有同分异构体的结构简式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:
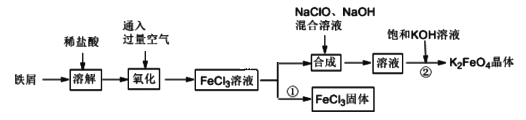
请回答下列问题:
(Ⅰ)(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为_______________________________。
(3)为了检验“氧化”过程中所得溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN 溶液 b.NaOH 溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液 e.酸性KMnO4溶液
(4)过程①制取FeCl3固体的具体操作步骤是_______________________。若使6.5 mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH 小于_________{已知该实验条件下,Ksp[(Fe(OH)3]=6.5×10-36,Kw=1.0×10-13(水离子积)}
(Ⅱ)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
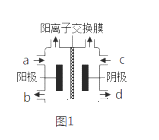
(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电解池总反应(化学方程式)__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列材料中含有硅元素的是( )
①水泥 ②玻璃 ③陶瓷 ④计算机芯片 ⑤压电材料 ⑥光缆
A. ①②③④⑤⑥ B. ①③⑤ C. ①②④ D. ④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com