
科目: 来源: 题型:
【题目】图为一常见的坐标曲线图。该图能够表示的生物学含义是

A. 人红细胞中K+吸收量随O2浓度变化的情况
B. 细胞代谢中反应速率随底物浓度变化的情况
C. 某植物光合作用速率随光照强度变化的情况
D. 萌发的种子中自由水含量随时间变化的情况
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3遇潮湿空气即产生大量白雾).可用下列装置制备.

(1)装置B中盛放__________溶液,其作用是___________.F中的是________溶液,其作用是_____________.用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为________.
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是_____________(填序号).
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积.装置如图所示(夹持器具已略去).反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变.气体体积逐次减小的原因是____________________(排除仪器和实验操作的影响因素).

(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8molH2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为_____________________。
(2)已知H2O(l) = H2O(g) ΔH= +44kJ/mol。
则16g液态肼与液态双氧水反应生成液态水时放出的热量是_________________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:X、Y、Z、W四种元素原子的电负性数值如表所示:
元素 | X | Y | Z | W |
电负性 | 2.5 | 4.0 | 1.2 | 2.4 |
上述四种元素中,最容易形成共价键的是( )
A.X与YB.X与WC.Y与ZD.Y与W
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。
②C中得到紫色固体和溶液。C中Cl2发生的反应有(请配平)
_____Cl2+ Fe(OH)3+ KOH![]() K2FeO4+ KCl+ H2O
K2FeO4+ KCl+ H2O
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有 Fe3+ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-
②根据K2FeO4的制备实验得出:氧化性Cl2________FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下所示。
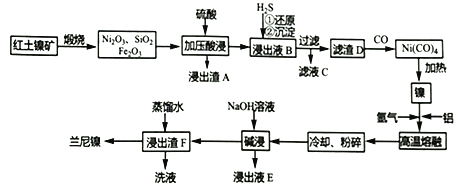
(1)形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________。
(2)Ni2O3有强氧化性,加压酸浸时有气体产生且镍被还原为Ni2+,则产生的气体为______(填化学式)。
(3)滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体时所有反应的离子方程式:__________________________,_________________________。
(4)已知:3Fe2++2[Fe(CN)6]3-==Fe3[Fe(CN)6]2↓(蓝色沉淀);下列可以用于检验滤液C中金属阳离子的试剂有____________(填标号)
a.KSCN溶液 b.K3[Fe(CN)6] c.K4[Fe(CN)6] d.苯酚
(5)仿照下面示例,设计从浸出液E回收氧化铝的流程:浸出液E_______________。
(示例:CuO![]() Cu2+
Cu2+![]() Cu)
Cu)
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是
A.Cu溶于氯化铁溶液:Cu+Fe3+=Cu2++Fe2+
B.Na2CO3溶液中加入醋酸:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
D.Ba(OH)2溶液与稀硫酸: Ba2++2OH—+2H++SO42—=BaSO4↓+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
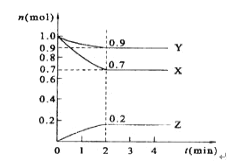
(1)X的转化率是_____;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=_____;
(4)当反应进行到第____min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为_____;
(5)该反应达平衡时的平衡常数表达式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:

(1)步骤I中涉及的主要反应用离子方程式表示为__________.
(2)步骤Ⅱ中试剂①是_______(填代号).
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
(3)步骤Ⅲ加入CuO 的目的是_________
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____________冷却结晶、过滤等操作.
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在坩埚中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=______(计算结果精确到0.1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com