
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
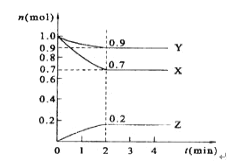
(1)X的转化率是_____;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=_____;
(4)当反应进行到第____min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为_____;
(5)该反应达平衡时的平衡常数表达式:_________。
【答案】30% 3X+Y![]() 2Z 0.05mol/(L·min) 2 50%
2Z 0.05mol/(L·min) 2 50% ![]()
【解析】
(1)根据转化率=![]() ×100%计算;
×100%计算;
(2)根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
(3)根据v=![]() 计算;
计算;
(4)根据化学平衡特征判断达到平衡的时间;根据平衡时体积百分比等于物质的量的百分比计算;
(5)根据反应式写出平衡常数表达式。
(1)由图可知,起始时X的物质的量为1.0mol,反应到2min时X的物质的量为0.7mol,所以转化的X为0.3mol,则X的转化率是:![]() ×100% =30%,
×100% =30%,
故答案为:30%;
(2)由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:3X+Y![]() 2Z,
2Z,
故答案为:3X+Y![]() 2Z;
2Z;
(3)反应开始至2min末,Z的反应速率为:v=![]() =
=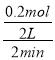 =0.05mol/(L·min),
=0.05mol/(L·min),
故答案为:0.05mol/(L·min);
(4)由图象可以看出,当反应进行到第2min,X、Y、Z的含量不再改变,该反应达到平衡。
平衡时X、Y、Z的物质的量分别为0.7mol、0.9mol和0.2mol,则Y所占体积的百分比为![]() ×100%=50%,
×100%=50%,
故答案为:2;50%;
(5)根据反应式3X(g)+Y(g)![]() 2Z(g),平衡常数表达式为:
2Z(g),平衡常数表达式为:![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】有四个干燥的烧瓶,在标准状况下,向①瓶中装入干燥、纯净的氨气,②瓶中装入干燥的含一半空气的氯化氢,③瓶中装入干燥、纯净的二氧化氮,④瓶中装入干燥的体积比V(NO2)∶V(O2)=4∶1的混合气体。做喷泉实验时四个烧瓶中所得溶液的物质的量浓度之比为(不考虑烧瓶中溶液的扩张)( )
A. 2∶1∶2∶2B. 5∶5∶5∶4C. 1∶1∶1∶1D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含有少量镁的铝片制取纯净的Al(OH)3时,下列操作中最恰当的组合是
①加盐酸溶解 ②加NaOH溶液溶解 ③过滤 ④通入过量的CO2生成Al(OH)3 ⑤加盐酸生成Al(OH)3 ⑥加过量的烧碱生成Al(OH)3
A.①⑤⑥③B.①③⑥③C.②③④③D.②③⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A. H2(g)B. CO(g)C. C8H18(l)D. CH4(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X、Y、Z、W四种元素原子的电负性数值如表所示:
元素 | X | Y | Z | W |
电负性 | 2.5 | 4.0 | 1.2 | 2.4 |
上述四种元素中,最容易形成共价键的是( )
A.X与YB.X与WC.Y与ZD.Y与W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与阿伏加德罗常数的值( NA)有关的说法正确的是
A. 在标准状况下,2.24L水中含有氢原子的数目为2NA
B. 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA
C. 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后可得到NH3分子数为NA
D. 2.3 g Na与氧气完全反应,反应中转移的电子数在0.1NA~0.2NA之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2为无色、有强烈刺激性气味的气体,是主要大气污染物之一,具有一定的还原性。
I. 探究 SO2 还原 Fe3+、I2。可使用的药品和装置如下图所示。

(1)实验室常用亚硫酸钠与 70%硫酸 加热制备二氧化硫,写出该反应的化学方程式_________________________________。
(2)B中可观察到的现象是__________________。
(3)C的作用是______________。
(4)设计实验检验A 中SO2与Fe3+反应所得还原产物____________________。
Ⅱ.某同学将SO2与漂粉精进行如下实验探究。
操 作 | 现 象 |
取适量漂粉精固体,加入 100 mL 水 | 大部分固体溶解,溶液略有颜色 |
过滤,用 pH 试纸测漂粉精溶液的 pH | pH 试纸先变蓝(约为12),后褪色 |
将 SO2 持续通入漂粉精溶液中 | ①溶液出现浑浊,并呈淡黄绿色 |
②一段时间后,产生较多白色沉淀,黄绿色褪去 | |
(1)由 pH 试纸颜色变化说明漂粉精溶液具有的性质是______________________________。
(2)①中溶液呈淡黄绿色的可能原因是_________________________________;用离子方程式解释②中溶液黄绿色褪去的主要原因___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com