
【题目】氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) △H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A. H2(g)B. CO(g)C. C8H18(l)D. CH4(g)
科目:高中化学 来源: 题型:
【题目】下列每组物质中含有的化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、CO2
C.HBr、CCl4、H2O、CO2
D.Na2O2、H2O2、H2O、O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温、定容条件下,不能标志H2(g)+I2(g)![]() 2HI(g)达化学平衡的是( )
2HI(g)达化学平衡的是( )
A. 单位时间内消耗a mol H2同时消耗2a mol HI
B. 容器内的总压强不随时间变化而变化
C. 容器内H2、I2不再减少,HI不再增加
D. 单位时间内每生成a mol HI,同时有aNA个HI分子分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. AlCl3![]() Al(OH)3
Al(OH)3 ![]() [Al(OH)4 ]-
[Al(OH)4 ]-
B. Fe2O3(s) ![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
C. NaHCO3(s)![]() Na2CO3
Na2CO3![]() NaOH(aq)
NaOH(aq)
D. Al(s)![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3 (s)
Al(OH)3 (s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
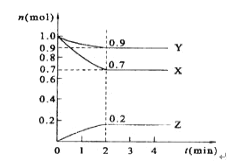
(1)X的转化率是_____;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=_____;
(4)当反应进行到第____min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为_____;
(5)该反应达平衡时的平衡常数表达式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3遇潮湿空气即产生大量白雾).可用下列装置制备.

(1)装置B中盛放__________溶液,其作用是___________.F中的是________溶液,其作用是_____________.用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为________.
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是_____________(填序号).
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积.装置如图所示(夹持器具已略去).反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变.气体体积逐次减小的原因是____________________(排除仪器和实验操作的影响因素).

(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(C1NO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用C12和NO制备C1NO并测定其纯度。请回答:
(I)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

(1)若制备C12发生装置选A,则反应的离子方程式为____________。若制备NO发生装置选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为________
(2)欲收集一瓶干燥纯净的氯气,选择装置,其连接顺序为:a→f→___→___→___→d→___→___→___(按气流方向,用小写字母表示),其中F装置的作用为____________。

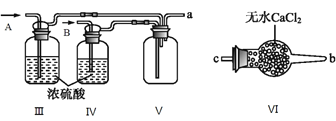
(II) 乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
(3)为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
(4)装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
(5)装置Ⅷ的烧杯中盛放的试剂是_____________(填编号①水②热水③冰水)
(6)装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是________,其中氧化性强的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com