
【题目】下列为含有极性键的非极性分子的是( )
A.SiCl4B.O2C.PCl3D.H2O
科目:高中化学 来源: 题型:
【题目】“组成不同生物的元素含量有不同”。对此现象的合理解释是( )
A. 组成细胞的化学元素在含量上具有差异性
B. 生物界与非生物界在元素含量上具有差异性
C. 生物根据自身生命活动的需要,有选择地从环境中吸收的元素
D. 生物体内元素的存在形式各不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
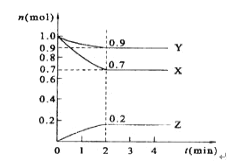
(1)X的转化率是_____;
(2)由图中所给数据进行分析,该反应的化学方程式为______;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=_____;
(4)当反应进行到第____min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为_____;
(5)该反应达平衡时的平衡常数表达式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课外活动小组利用以下装置完成系列实验.请回答以下问题:
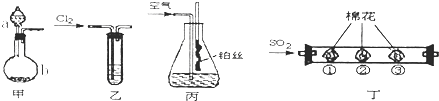
(1)装置甲中仪器a的名称为___ . 用装置甲制取NH3 , 在b中加入CaO固体,a中加入浓氨水,写出反应的化学方程式:___ .
(2)将C12持续通入装有淀粉一KI无色溶液的装置乙中,溶液变蓝而后逐渐褪色.查阅资料得知:溶液蓝色逐渐褪色,是因为有+5价的碘元素生成.请写出该反应的离子方程式:___ .
(3)用装置丙模拟“氨的催化氧化”实验.锥形瓶内装有浓氨水,通入空气,并将红热的铂丝插入锥形瓶内,铂丝保持红热.铂丝保持红热的原因是___;锥形瓶内还可观察到现象是___ .
(4)活动小组从“绿色化学”角度出发.在装置丁中进 行SO2的性质实验.其中棉花上蘸有不同试剂.请填写表中空白:
棉花位置 | ① | ② | ③ |
棉花上蘸有的试剂 | 品红溶液 | 酸性高锰酸钾溶液 | ___ |
现象 | ___ | 溶液紫色褪去 | 无 |
结论 | SO2具有漂白性 | SO2具有___ | SO2有毒,不能排空 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(C1NO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用C12和NO制备C1NO并测定其纯度。请回答:
(I)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

(1)若制备C12发生装置选A,则反应的离子方程式为____________。若制备NO发生装置选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为________
(2)欲收集一瓶干燥纯净的氯气,选择装置,其连接顺序为:a→f→___→___→___→d→___→___→___(按气流方向,用小写字母表示),其中F装置的作用为____________。

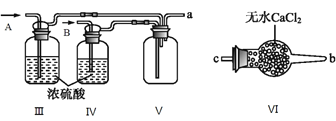
(II) 乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
(3)为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
(4)装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
(5)装置Ⅷ的烧杯中盛放的试剂是_____________(填编号①水②热水③冰水)
(6)装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 |
A.C6H14B.C6H12C.C7H12D.C7H14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用。A的结构简式为:

已知:①在一定条件下,羧酸酯或羧酸与含—NH2的化合物反应可以生成酰胺,如:

②酯比酰胺容易水解。
![]()
请填写下列空白:
(l)在稀酸条件下加热,化合物A首先生成的水解产物是:________和______。
(2)在较浓酸和长时间加热条件下,化合物A可以水解生成:______________、________________和__________________。
(3)化合物A分子内的官能团之间也可以发生反应,再生成一个酰胺键,产物是甲醇和__________________________。(填写结构简式,该分子中除苯环以外,还含有一个6原子组成的环)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业生产硼砂所得废渣硼镁泥(主要含 MgO、SiO2、Fe2O3,另含少量 FeO、CaO、 Al2O3 、B2O3 等)为原料制取 MgSO4·7H2O 的工艺流程如下:

回答下列问题:
(1)过滤需用到的玻璃仪器有玻璃棒、烧杯和_______;其中玻璃棒的作用是___________。
(2)滤渣 1 中的某种物质 是玻璃的主要成分之一,玻璃另外两种主要成分的化学式为_____________。除杂过程加入MgO 的作用是__________________。
(3)写出除杂过程中次氯酸钙将 Fe2+氧化的离子方程式__________________。
(4)除杂过程中,当 c(Al3+)=1×105 mol/L 时,c(Fe 3+)=__________mol/L。(已知Ksp [Al(OH)3] = 3.2×1034 , Ksp[Fe(OH)3]= 1.1×1036,结果保留两位有效数字 )
(5)滤渣 3 主要成分的化学式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出H2O2电子式___;上述反应的热化学方程式______。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是____kJ。
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com